indyjski

- 3025
- 717
- Pani Waleria Marek
 Metaliczny indyjski utwór. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez (https: // creativeCommons.Org/licencje/według/3.0)]
Metaliczny indyjski utwór. Źródło: obrazy Hi-Resa elementów chemicznych [CC przez (https: // creativeCommons.Org/licencje/według/3.0)] Co to jest Indianin?
On indyjski Jest metalem, który należy do grupy 13 stolika okresowego i ma symbol chemiczny w. Twój numer atomowy to 49, 49I jest przedstawiany w naturze jako dwa izotopy: 113W I 115W tym ostatnim jest najbardziej obfity. Na Ziemi atomy indyjskie znajdują się jako zanieczyszczenia w cynku i minerałach.
Jest to szczególny metal, ponieważ jest to najmiększe, które można dotknąć bez wielu zagrożeń dla zdrowia; W przeciwieństwie do litu i rubidium, które okropnie spaliłoby skórę podczas reakcji z jego wilgocią. Kawałek Indii można wyciąć nożem i złamać siłą palców, emitując charakterystyczny chrupnięcie.
Ktokolwiek słyszy o tym metalu, z pewnością przychodzi mi na myśl Indie, ale jego imię wywodzi się z koloru indygo, co jest obserwowane podczas przeprowadzania testu płomienia. W tym sensie wygląda całkiem dużo potasu, spalając jego metal lub związki bardzo charakterystycznym płomieniem, przez które Indianin został wykryty po raz pierwszy w minerałach sfensetowych.
Indyjski dzieli wiele właściwości chemicznych z aluminium i galeum, prezentując się w większości związków z liczbą utleniania +3 (w3+). Wspólnie łączy się ze stopami tworzącymi Gaul z niskimi punktami topnienia, jednym z nich jest Galinstan.
Aplikacje indyjskie oparte są na podszewce materiałów z ich stopami, co czyni je elektrycznymi i elastycznymi przewodami. Hindus ma trochę szkła, aby przyznać im większe błyszczy, zastępując srebro. W świecie technologii Indianina znajduje się na ekranach dotykowych i LCD.
Odkrycie
W 1863 r. Niemiecki chemik Ferdynand Reich szukał śladów elementu Talio, wykorzystując zieloną linię jego widma emisji, w minerałach Cinc; W szczególności próbki sfalerytu (ZNS) wokół saksonii. Po opiekaniu minerałów usuń zawartość siarki, trawić je kwasem chlorowodorowym i destyl chlorek cynku, uzyskał osad piwizo.
Biorąc pod uwagę odkrycie, Reich postanowił przeprowadzić analizę spektroskopową; Ale ponieważ nie miał dobrych oczu, aby obserwować kolory, poszedł do swojego kolegę Hariomusa Theodora Richtera, aby pomóc mu w tym zadaniu. Richter był tym, który zaobserwował niebieskawą linię widmową, która nie pasowała do spektrum żadnego innego elementu.
Może ci służyć: kwas jodozowy (Hio2): właściwości i zastosowaniaDwaj niemieccy chemicy stawiali czoła nowemu elementowi, który nazywał się indyjskim kolorem dla indygo, gdy płonęły ich związki; A z kolei nazwa tego koloru pochodzi od łacińskiego słowa Indicum, Co oznaczają Indie.
Rok później, w 1864 r., Podekscytowani i po przedłużonej serii opadów i oczyszczenia, wyizolowali próbkę metalicznych Indian poprzez elektrolizę rozpuszczonych soli w wodzie.
Struktura indyjska
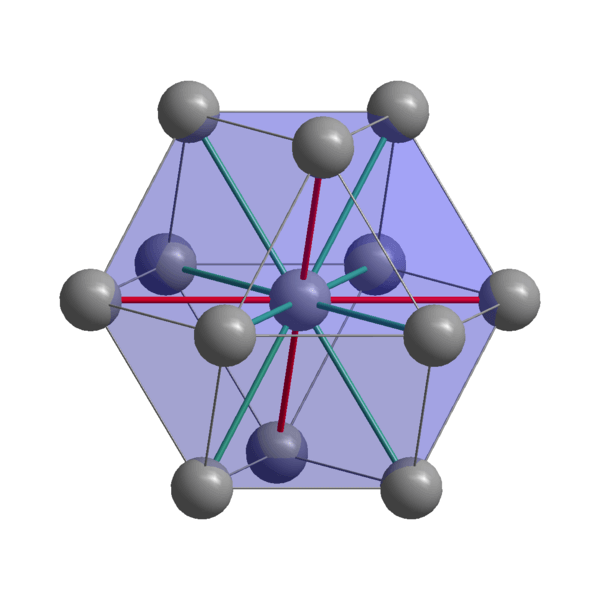 Indyjska struktura krystaliczna
Indyjska struktura krystaliczna Indyjskie atomy kohezji za pomocą elektronów walencyjnych w celu ustanowienia wiązania metalowego. W ten sposób są one uporządkowane w zniekształconej strukturze tetragonalnej wyśrodkowanej na ciele. Interakcje między atomami w sąsiedztwie są stosunkowo słabe, co wyjaśnia, dlaczego Indian ma niską temperaturę topnienia (156 ° C).
Z drugiej strony siły łączące dwa lub więcej indyjskich kryształów również nie są silne, w przeciwnym razie nie poruszałyby się na siebie, nadając charakterystyczną miękkość metalu.
Nieruchomości indyjskie
Wygląd fizyczny
To niezwykle miękki srebrny metal. Może rozerwać ciśnieniem paznokcia, pokroić nożem lub drapać się w jasnych pociągnięciach na kartce papieru. Możliwe jest nawet przeżuwanie go i zdeformowanie zębów, pod warunkiem, że jest spłaszczony. Jest również bardzo plastyczny i plastyczny, ma właściwości z tworzyw sztucznych.
Kiedy Indian ogrzewali pochodnią, odrzuca płomień koloru indygo, nawet jaśniejszy i bardziej kolorowy niż w potasu.
Masa cząsteczkowa
114,81 g/mol
Temperatura topnienia
156,60 ºC
Punkt wrzenia
2072 ºC.
Podobnie jak GAUL, Indianin ma duży przedział temperatury między punktem fuzji a gotowaniem. Odzwierciedla to fakt, że interakcje w cieczy są silniejsze niż te, które dominują w szkle; I dlatego łatwiej jest uzyskać kroplę Indian niż ich opary.
 Lokalizacja indyjska w stole okresowym. Źródło: Daniel Mayer lub Greatpatton Vectorisation: Sushant Savla, CC BY-SA 3.0, Via Wikimedia Commons
Lokalizacja indyjska w stole okresowym. Źródło: Daniel Mayer lub Greatpatton Vectorisation: Sushant Savla, CC BY-SA 3.0, Via Wikimedia Commons Gęstość
W temperaturze pokojowej: 7,31 g/cm3
W momencie topnienia: 7,02 g/cm3
Elektronialiczność
1.78 na skali Pauling
Energie jonizacyjne
Po pierwsze: 558,3 kJ/mol
Drugi: 1820.7 kJ/mol
Po trzecie: 2704 kJ/mol
Przewodność cieplna
81,8 W/(M · K)
Rezystancja
83,7 nω · m
Twardość mohs
1.2. Jest to zaledwie trochę trudniejsze niż talk (nie jest to trudne do mylącego wytrwałości).
Reaktywność
Indian rozpuszcza kwasy, powodując sole, ale nie rozpuszczają się w roztworach alkalicznych, nawet z gorącym wodorotlenkiem potasowym. Reaguje w bezpośrednim kontakcie z siarką, tlenem i halogenami.
Może ci służyć: rozcieńczenie: koncepcja, jak to się robi, przykłady, ćwiczeniaIndianin jest stosunkowo amfoteryczny, ale zachowuje się bardziej jako podstawa niż kwas, będąc lekko podstawowymi roztworami wodnymi. The IN (OH)3 Jest to ponowne zużycie większej liczby alkalis powodujących kompleksy Indiate, w (OH)4-, Jak w przypadku aluminianów.
Elektroniczna Konfiguracja
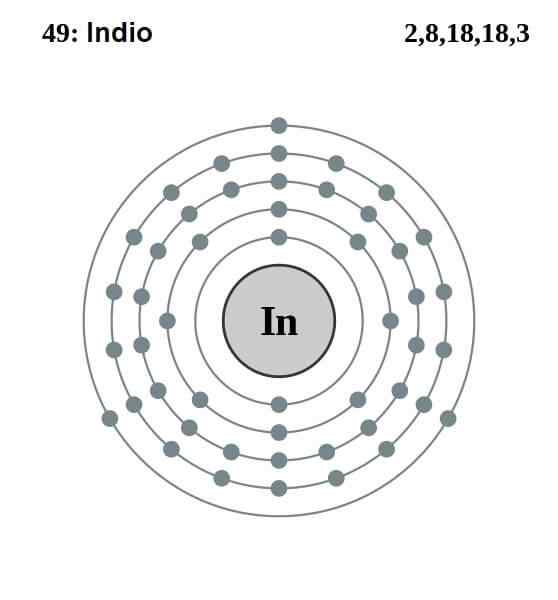 Elektroniczna konfiguracja indyjska
Elektroniczna konfiguracja indyjska Konfiguracja elektroniczna Indian jest następująca:
[Kr] 4d10 5s2 5 p1
Spośród tych trzynastu elektronów ostatnie trzy z orbitali 5s i 5p to Walencja. Z tymi trzema elektronami indyjskie atomy ustanawiają wiązanie metalowe, podobnie jak aluminium i galu, tworzą kowalencyjne wiązania z innymi atomami.
Liczby utleniania
Powyższe jest używane od razu, aby Indianinowi stracić trzy elektrony Walencji lub wygrać pięć, aby stać się izolektronicznym i szlachetnym gazem ksenonowym.
Jeśli w związku zakładamy, że stracił trzy elektrony, pozostanie on jako trójwagiczny kation w3+ (Analogia Al3+ i Ga3+), a zatem twój numer utleniania wyniesie +3. Większość związków indyjskich znajduje się w (iii).
Wśród innych liczby utleniania znalezionych dla Indian mamy: -5 (w5-), -2 (w2-), -1 w-), +1 (w+) i +2 (w2+).
Niektóre przykłady związków w (i) to: inf, w tym INBR, INI i In2ALBO. Wszystkie są stosunkowo rzadkie związki, podczas gdy w (iii) są dominujące: w (OH)3, W2ALBO3, W tym3, Inf3, itp.
W (i) związkach to silne środki redukujące, w których w In+ przekazać dwa elektrony innym gatunkom, aby się stać3+.
Izotopy
Indianin jest prezentowany w naturze jako dwa izotopy: 113W I 115W, których obfitości gruntów wynosi odpowiednio 4,28% i 95,72%. Dlatego na Ziemi mamy o wiele więcej atomów 115W tym 113W. On 115W ma pół -life 4,41,1014 lata, tak świetne, że jest praktycznie uważane za stabilne, mimo że jest radioizotopem.
Obecnie utworzono w sumie 37 sztucznych izotopów Indian, wszystkie radioaktywne i bardzo niestabilne. Spośród nich najbardziej stabilnym jest 111W, który ma pół -life wynoszącą 2,8 dni.
Używa/aplikacje
Stopy
Indianin bardzo dobrze dogaduje się z galem. Oba metale tworzą stopy MEL. Ponadto Indianin jest również łatwy do połączenia, ma 57% rozpuszczalności w rtęci.
Może ci służyć: kwas octowy (CH3COOH)Stopy indyjskie służą do projektowania srebrnych luster bez uciekania się do srebrnego. Kiedy są wylewane na obszar dowolnego materiału, działa on jako zwolennik, dzięki czemu można zebrać szkło, metal, kwarc i ceramikę.
elektronika
 Bez indyjskich ekranów dotykowych nigdy nie istniałyby
Bez indyjskich ekranów dotykowych nigdy nie istniałyby Indianin również dogaduje się z Germano, więc jego związki są dodawane jako domieszki do germańskiego nitruro diod LED, odtwarzając te mieszanki niebieskie światła, fioletowe i zielone. Jest także częścią tranzystorów, termistorów i komórek fotowoltaicznych.
Najważniejszym z jego związków jest cyna i tlenek indyjski, który jest używany jako szklana podszewka do odbicia niektórych długości fali. To pozwala być używane w okularach spawalniczych i w szkle, aby nie podgrzewały się w środku.
Szkło pokryte tym tlenek to dobre przewody energii elektrycznej; Jak ten z naszych palców. I dlatego jest przeznaczony do produkcji ekranów dotykowych, jeszcze bardziej aktualnej aktywności ze względu na pojawienie się coraz większej liczby smartfonów.
Ryzyko
 Indian w stanie stałym. Źródło: w. Oelen, CC BY-SA 3.0, Via Wikimedia Commons
Indian w stanie stałym. Źródło: w. Oelen, CC BY-SA 3.0, Via Wikimedia Commons Indianin nie reprezentuje przede wszystkim żadnego ryzyka dla środowiska, ponieważ w jonach w3+ Nie są rozpowszechniane w znacznych ilościach. Nie ma informacji o tym, jaki byłby jego wpływ na gleby, wpływając na rośliny, ani ani w faunie ani morze.
W ciele nie wiadomo, czy jony w3+ Mają niezbędny udział w metabolizmie w ilościach śladów. Jednak gdy ich związki są spożywane, są one szkodliwe dla kilku narządów, dlatego są uważane za wysoce toksyczne substancje.
W rzeczywistości cząstki ITO (tlenek cyny i indyjski, ze względu na akronim w języku angielskim: Indu tlenku cyny), niezbędne do produkcji ekranów dla komputerów i smartfonów, mogą negatywnie wpłynąć na zdrowie pracowników, powodując chorobę zwaną płucami indyjskimi.
Spożycie tych cząstek występuje przede wszystkim przez inhalację i kontakt przez skórę i oczy.
Z drugiej strony drobne metaliczne cząstki indyjskie są podatne na oparzenie i powodują pożary, jeśli są ogrodzeniem źródłem ciepła.

