Struktura hormonów steroidowych, synteza, mechanizm działania
- 4867
- 1389
- Paweł Malinowski
Hormony steroidowe Są to substancje wytwarzane przez wewnętrzne gruczoły wydzielania i które zrzucają bezpośrednio do torrentu krążenia, co prowadzi do tkanek, w których wywierają działanie fizjologiczne. Jego ogólna nazwa wywodzi się z faktu, że posiadanie rdzenia sterydowego w podstawowej strukturze.
Cholesterol jest substancją prekursorową, z której zsyntetyzowane są wszystkie hormony steroidowe, które są grupowane w progestjanie (na przykład progesteron), estrogeny (stronowanie), androgeny (testosteron), glukokortykoidy (kortyzol), mineralokortykoidy (aldosteron) i witaminę Diciny D.
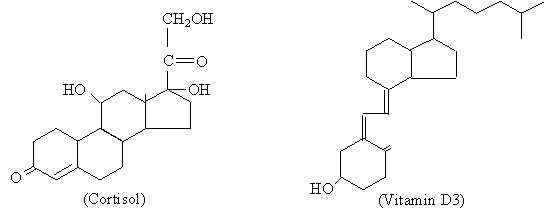
 Porównanie struktury hormonu steroidowego (kortyzolu) z cząsteczką o tej samej naturze chemicznej (witamina D3) (źródło: oryginalnym przesyłaniem był Palladius na angielskiej Wikipedii. [Domena publiczna] za pośrednictwem Wikimedia Commons)
Porównanie struktury hormonu steroidowego (kortyzolu) z cząsteczką o tej samej naturze chemicznej (witamina D3) (źródło: oryginalnym przesyłaniem był Palladius na angielskiej Wikipedii. [Domena publiczna] za pośrednictwem Wikimedia Commons) Chociaż różne hormony steroidowe występują wśród nich różnice molekularne, które są tymi, które nadają różne właściwości funkcjonalne, można powiedzieć, że mają one podstawową strukturę, która jest dla nich wspólna i która jest reprezentowana przez cyklopentanoperhydrofenantreno z 17 atomów węgla.
[TOC]
Struktura steroidowa
Steroidy są związkami organicznymi o bardzo różnorodnym charakterze, które mają wspólne to, co można uznać za jądro progenitorowe składające się z fuzji trzech pierścieni sześciu atomów węgla (cykloheksan) i jednego z pięciu atomów węgla (Cyclopentano).
Ta struktura jest również znana jako „Cyclopentanoperhydrofenantreno”. Ponieważ pierścienie są zjednoczone wzajemnie, całkowite atomy węgla, które go składają, wynoszą 17; Jednak większość naturalnych sterydów.
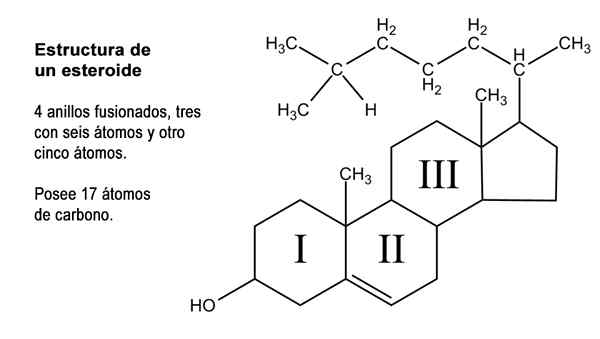
 Schemat czterech pierścieni struktury cyklopentanoperhidrofenantreno (źródło: Neurotokeker [domena publiczna] za pośrednictwem Wikimedia Commons)
Schemat czterech pierścieni struktury cyklopentanoperhidrofenantreno (źródło: Neurotokeker [domena publiczna] za pośrednictwem Wikimedia Commons) Wiele naturalnych związków sterydowych ma również jedną lub więcej grup z funkcją alkoholową, a zatem otrzymuje nazwę steroli. Wśród nich jest cholesterol, który ma funkcję alkoholu w węglu 3 i boczny łańcuch węglowodorów 8 atomów węgla z węglem 17; atomy ponumerowane od 20 do 27.
 Struktura sterydów. Zmodyfikowany obraz Marcotolo/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.5)
Struktura sterydów. Zmodyfikowany obraz Marcotolo/CC BY-S (https: // creativeCommons.ORG/Licencje/BY-SA/2.5) Oprócz tych 17 węgli, hormony steroidowe mogą mieć w swojej strukturze 1, 2 lub 4 więcej z tych atomów, więc rozpoznawane są trzy typy sterydów, a mianowicie: C21, C19 i C18.
C21
C21, takie jak progesteron i kortykosteroidy nadnerczy (glukokortykoidy i mineralokortykoidy), pochodzą z „ciąży”. Ma to 21 atomów węgla, ponieważ przy 17 pierścienia podstawowego dodaje się dwie grupy metylowe węgli 13 i 10, a dwa węgły łańcucha bocznego przymocowane do C17, które pierwotnie w cholesterolu było to 8 węgli.
C19
C19 odpowiada hormonom płciowym z aktywnością androgeniczną i wywodzi się z „androstano” (19 atomów węgla), która jest strukturą, która pozostaje, gdy w ciąży traci dwa węglowodany łańcucha bocznego C17, który zastępuje hydroksyl lub hydroksyl lub hydroksylowa grupa ketoniczna.
C18
Steroidy C18 to hormony żeńskie lub estrogenowe, które są głównie syntetyzowane u samic gonad i których znaczącą cechą, w odniesieniu do pozostałych dwóch rodzajów sterydów, jest brak metylu obecnego w tym ostatnim związanym z węglem w pozycji 10.
Podczas syntezy z cholesterolu wytwarzane są modyfikacje enzymatyczne, które zmieniają liczbę węgli i promują odwodornienie i hydroksylacje określonych węgli struktury.
Synteza
Komórki wytwarzające hormony steroidowe znajdują się głównie w kory nadnerczy, gdzie glukokortykoidy, takie jak kortyzol, mineralokortykoidy, takie jak aldosteron i męskie hormony płciowe, takie jak dehydroepijoderon i androstena.
Męskie gonady seksualne są odpowiedzialne za produkcję androgenów, które zawierają hormony już wspomniane i testosteron, podczas gdy pęcherzyki jajnika, które osiągają dojrzewanie, wytwarzają progesteron i estrogen.
Może ci służyć: połowa mojego: co to jest, podkład, przygotowanie, użycieSynteza wszystkich hormonów steroidowych zaczyna się od cholesterolu. Ta cząsteczka może być syntetyzowana przez komórki wytwarzające hormony steroidowe, ale głównie komórki te otrzymują z lipoprotein o niskiej gęstości (LDL) obecnych w krążącym plazmie.
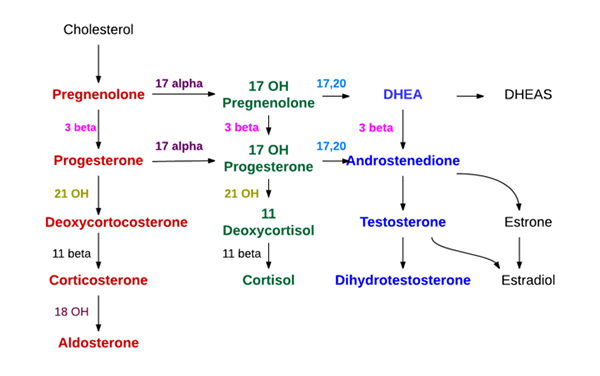 Synteza hormonów nadnerczych (źródło: Doktor Endokrynujący [CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Synteza hormonów nadnerczych (źródło: Doktor Endokrynujący [CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) - Synteza na poziomie kory nadnerczy
Trzy warstwy wyróżniają się w korze nadnerczy, znanej z zewnątrz odpowiednio jako strefy kłębuszkowe, fascikularne i siatkowe.
W kłębuszkach są one zasadniczo zsyntetyzowane mineralokortykoidy (aldosteron), w foskularnych glukokortykoidach, takich jak kortykosteron i kortyzol, oraz w siatkowatym androgena.
Synteza glukokortykoidów
Pierwszy krok w syntezie występuje w mitochondriach i obejmuje działanie enzymu zwanego demollasą cholesterolu, należącą do nadrodziny cytochromu P450, a także znany jako „P450SCC” lub „CYP11A1”, który promuje eliminację 6 z 6 z 6 z Atomy węgla łańcucha bocznego przymocowane do C17.
Wraz z działaniem demolazy cholesterol (27 atomów węgla) staje się ciążynolonem, który jest związek z 21 atomami węgla i reprezentuje pierwszy ze sterydów typu C21.
Ciąża porusza się do gładkiego retikulum endoplazmatycznego, gdzie przez działanie enzymu 3β-hydroksiesteroidowe dehydrogenazy.
Poprzez działanie 21β-hydroksylazy, zwanej także „P450C21” lub „CYP21A2”, progesteron jest hydroksyle w węglowym 21 i przekształca się w 11-dektykosteron, który wraca do mitochondria, a do którego enzym 11β-hydroksylazy („” P450C11 ”lub„ CYP11B1 ”) przekształca się w kortykosteron.
Kolejna linia syntezy w strefie faszyckowej i ta nie kończy się w kortykosteronie, ale w kortyzolu, występuje, gdy ciążalon lub progesteron jest hydroksylowany w pozycji 17 przez 17α-hydroksylazę („P450C17” lub „CYP17”) i przemieszczone w 17-hydroksynolonu ( lub 17-hydroksiprgesteron.
Ten sam już wspomniany enzym, dehydrogenaza 3β-hydroksiesteroidów, która przekształca ciąży w progesteron, również przekształca 17-hydroksypnenolen w 17-hydroksiprgesteron.
Te ostatnie są przenoszone sukcesywnie, przez ostatnie dwa enzymy drogi, które wytwarzają odpowiednio kortykosteron (21β-hydroksylazę i 11β-hydroksylaza) do dezoksyksyktyzolu i kortyzolu.
Działania glukokortykoidalne
Głównymi glukokortykoidami wytwarzanymi w strefie powłokowej kory nadnerczy to kortykosteron i kortyzol. Obie substancje, ale szczególnie kortyzolu, wykazują szerokie spektrum działań, które wpływają.
Jeśli chodzi o metabolizm, kortyzol stymuluje lipolizę i uwalnianie kwasów tłuszczowych, które można zastosować w wątrobie do tworzenia ciał ketonowych o niskiej gęstości (LDL); zmniejsza zbieranie glukozy i lipogenezę w tkance tłuszczowej oraz zbieranie i stosowanie glukozy w mięśniu.
Promuje również katabolizm białkowy na peryferiach: w tkance złącza, mięsień i matrycy kostnej, która jest uwalniana aminokwasami, które można zastosować w wątrobie do syntezy białek plazmatycznych i do glukoneogenezy. Dodatkowo stymuluje wchłanianie glukozy jelitowej poprzez zwiększenie produkcji transporterów SGLT1.
Przyspiesz wchłanianie jelit glukozy, zwiększenie wytwarzania wątroby i zmniejszone stosowanie tego węglowodanów w mięśniach i tkance tłuszczowej sprzyja podwyższaniu poziomu glukozy w osoczu.
Jeśli chodzi o krew, kortyzol sprzyja procesie krzepnięcia, stymuluje tworzenie neutrofili i hamuje tworzenie eozynofili, bazofili, monocytów i limfocytów T. Hamuje także wyzwolenie mediatorów stanu zapalnego, takich jak prostaglandyny, interleukiny, limfocyny, histamina i serotonina.
Może ci służyć: chemiorreceptorOgólnie rzecz biorąc, można powiedzieć, że glukokortykoidy zakłócają odpowiedź immunologiczną, dzięki czemu można je stosować terapeutycznie w przypadkach, w których ta odpowiedź jest przesadzona lub nieodpowiednia, jak w przypadku chorób autoimmunologicznych lub w przeszczepach narządów w celu zmniejszenia odrzucenia odrzucenia.
- Synteza androgenowa
Androgenna synteza na poziomie kory nadnerczy jest głównie na poziomie strefy siatkowej i z 17-hydroksipregneolonu i 17-hydroksiprgesteron.
Ta sama enzym 17α-hydroksylaza, która wytwarza dwie świeżo wymienione substancje, ma również aktywność 17,20 Liasa, która tłumi dwa węglowodany łańcucha bocznego C17 i zastępuje je grupą keto (= O).
Ta ostatnia akcja zmniejsza liczbę węgli i wytwarza sterydy typu C19. Jeżeli działanie nastąpi na 17-hydroksypnenolun, wynikiem jest dehydroepianderon; Jeśli wręcz przeciwnie, dotkniętą substancją jest hydroksyprgesteron, produktem będzie androsten.
Oba związki są częścią tak zwanych 17-zosteroidów, ponieważ mają grupę ketonową w węglu 17.
Dehygenaza 3β-hydroksysteroidowa przekształca również dehydroepijoderon w androstenu.
Synteza mineralokortykoidów (aldosteron)
Strefa kłębuszkowa nie ma enzymu 17α-hydroksylazy i nie może zsyntetyzować 17-hydroksiesteroidowych prekursorów kortyzolu i hormonów płciowych. Nie ma też 11β-hydroksylazy, ale enzym zwany syntezazą aldosteronu, która może wytwarzać sekwencyjnie kortykosteron, 18-hydroksychoryczny i aldosteronowy mineralokortykoidalny.
Działania mineralokortykoidalne
Najważniejszym mineralokortykoidem jest zsyntetyzowany aldosteron w strefie kłębuszkowej kory nadnerczy, ale glukokortykoidy również wykazują aktywność mineralokortykoidów.
Aktywność mineralokortykoidów aldosteronu jest rozwijana na poziomie nabłonka kanalików dystalnych cieczy na ciele nerki.
- Synteza męskich sterydów płciowych w jądrach
Synteza jąder androgenu występuje na poziomie komórek Leydiga. Testosteron jest głównym hormonem androgenicznym wytwarzanym w jądrach. Jego synteza implikuje początkową wytwarzanie androstenediona, jak opisano wcześniej dla syntezy androgenów na poziomie kory nadnerczy.
Andosteneciona przekształca się w testosteron przez działanie enzymu 17β-hydroksiesteroidowego dehydrogenazy, która zastępuje grupę ketonową węgla 17 grupą hydroksylową (OH).
W niektórych tkankach, które służą jako cel testosteronu, jest to zmniejszone przez 5α-reduktazę do dihydrotestosteronu, o większej mocy androgenicznej.
- Synteza żeńskich sterydów płciowych w jajnikach
Ta synteza występuje cyklicznie towarzyszącymi zmianom, które występują podczas żeńskiego cyklu seksualnego. Synteza występuje w pęcherzyku, który podczas każdego dojrzałego cyklu w celu uwolnienia jaja, a następnie wytworzenia odpowiedniego ciała luteum.
Estrogeny są syntetyzowane w ziarnistych komórkach dojrzałego pęcherzyka. Dojrzały pęcherzyk ma komórki w drewnie tekowym, które wytwarzają androgeny, takie jak androstenediona i testosteron.
Hormony te rozprzestrzeniły się na sąsiednie granadowe komórki, które mają enzym aromatazy, który czyni je szarpaniem (E1) i 17β-strradiol (E2). Z obu z nich Striol jest syntetyzowany.
Działania sterydów seksualnych
Andogeny i estrogeny mają jako główną funkcję rozwój odpowiednio męskich i żeńskich postaci seksualnych. Andogeny mają efekty anaboliczne promujące syntezę białek strukturalnych, podczas gdy estrogeny sprzyjają procesie kostiumania.
Estrogeny i progesteron uwalniane podczas żeńskiego cyklu seksualnego są skierowane.
Może ci służyć: flora i fauna Baja California SurMechanizm akcji
Jeśli chcesz odświeżyć pamięć o mechanizmie działania hormonalnego, zaleca się wizualizację następującego filmu przed kontynuowaniem.
Mechanizm działania hormonów steroidowych jest bardzo podobny. W przypadku związków lipofilowych rozpuszczają się bez trudności w błonie lipidowej i penetrują cytoplazmie ich białych krwinek, które mają specyficzne receptory cytoplazmatyczne dla hormonu, na które muszą reagować.
Po utworzeniu kompleksu hormonu-receiiera przecina błonę jądrową i łączy się w genomie, w sposób czynnika transkrypcji, z elementem odpowiedzi na hormon (HRE) lub genu pierwotnego odpowiedzi, który do jego regulacji można regulować Inne geny odpowiedzi wtórnej.
Ostatecznym rezultatem jest promocja transkryptu i syntezy posłańców RNA, które są tłumaczone na rybosomy szorstkiego retikulum endoplazmatycznego, które kończą syntetyzację białek indukowanych hormonami.
Aldosteron jako przykład
 Cząsteczka aldosteronu
Cząsteczka aldosteronu Działanie aldosteronu jest wykonywane głównie na poziomie końcowej części dystalnej rurki i w kanałach kolekcjonerskich, gdzie hormon sprzyja reabsorpcji Na+ i wydzielanie k+.
W błonie światła głównych komórek rurowych tego regionu znajdują się kanały nabłonkowe kanałów Na+ i K+ typu angielskiego (z angielskiego Nerkowy zewnętrzny rdzeniasty kanał potasu).
Membrana podstawno -boczna ma pompy Na+/K+ ATPASA, które stale pobierają Na+ z komórki do podstawno -bocznej przestrzeni śródmiąższowej i wprowadzają K+ do wnętrza komórki. Ta aktywność zachowuje wewnątrzkomórkowe stężenie Na+ bardzo niskie i sprzyja tworzeniu gradientu stężenia dla tego jonu między światłem kanalików a komórką.
Ten gradient pozwala Na+ poruszać się w kierunku komórki przez kanał nabłonkowy, a gdy na+ przechodzi sam, dla każdego jonu, który się porusza, występuje niekompensowane obciążenie ujemne, które powoduje, że światło kanalików staje się ujemne w odniesieniu do śródmiąższu. Oznacza to, że różnica potencjałów transsepitelialnych jest tworzona za pomocą światła negatywnego.
Ta negatywność światła sprzyja wyjściu K+, które poruszało się przez jego większe stężenie w komórce, a negatywność światła jest wydzielana w kierunku światła kanalików, które ma być ostatecznie wydalane. To właśnie ta aktywność resorpcji Na+ i wydzielanie K+ jest regulowane przez działanie aldosteronu.
Aldosteron obecny we krwi i uwalniany ze strefy kłębuszkowej w odpowiedzi na działanie angiotensyny II lub na hiperkaliemia, wnika do głównych komórek i łączy jej receptor wewnątrzglazowy.
Ten kompleks dociera do jądra i promuje transkrypcję genów, których ekspresja zwiększy syntezę i aktywność pomp Na+/K+, kanałów nabłonkowych Na+i kanałów ROMK K+, a także innych białek więcej. Odpowiedź, która będzie miała zatrzymanie Na+ w organizmie i wzrost wydalania moczu k+.
Bibliografia
- Ganong WF: The Adrenal Medulla & Adrenal Cortex, 25. wydanie. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Hormony adrenokortyczne, w Podręcznik fizjologii medycznej , 13th Ed, AC Guyton, Je Hall (red.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: hormon, w Physiologie des Menschen roztoczy patofizjologa, 31 TH ED, RF Schmidt i in. (Eds). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Endokrines System, w: Physiologie, 6. wydanie; R Klinke i in. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H i Strang KT: Fizjologia reprodukcyjna żeńska, w ludzkiej fizjologii Vandera: mechanizmy funkcji ciała, wydanie 13; EP Widmaier i in. (Eds). Nowy Jork, McGraw-Hill, 2014.
- « Współczynnik tarcia statycznego, przykład, ćwiczenie
- AMPère Formuła i równania prawo, demonstracja, ćwiczenia »

