Struktura wodorku aluminiowego (ALH3), właściwości, zastosowania
- 4637
- 564
- Paweł Malinowski
On Wodork aluminiowy Jest to związek nieorganiczny, którego wzorem chemicznym jest ALH3. Chociaż wydaje się to prosta natura, w rzeczywistości jest to nieco skomplikowana substancja. Ze względu na krystaliczną jasność, która może wystąpić w jego stałym, jest zwykle przyjmowana jako wodorek jonowy, utworzony przez jony3+ i H-.
Jednak jego właściwości pokazują inaczej: jest to polimeryczna substancja stała, której najbardziej wierna reprezentacja byłaby tego typu (ALH3)N, istnienie N Liczba monomerycznych jednostek ALH3 To zintegrowałoby szklany łańcuch lub warstwę. Dlatego ALH3 Jest to jeden z tych polimerów, który udaje się przyjąć krystaliczną strukturę.
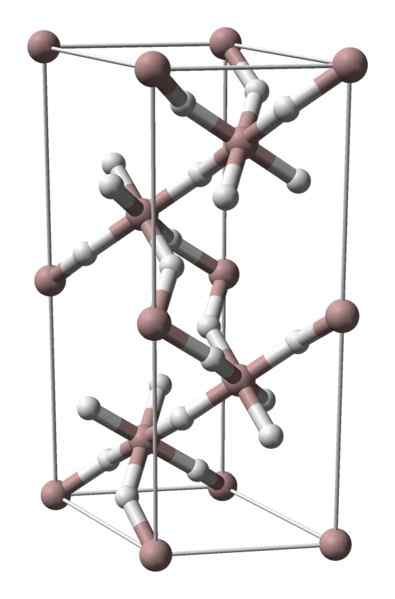 Krystaliczna struktura wodorku aluminium. Źródło: Benjah-BMM27 / Public Domena
Krystaliczna struktura wodorku aluminium. Źródło: Benjah-BMM27 / Public Domena Aluminiowy wodorek nie jest stałym z dużą ilością komercyjnej dyfuzji, więc jego dostępne obrazy są rzadkie. Jest szczególnie stosowany do syntezy organicznej, gdzie służy jako silny środek redukujący. Zajmuje również szczególne miejsce w technologicznym postępie materiałów, jest obiecującą alternatywą dla magazynowania wodoru.
Ten związek, zwany także ALANO, utrzymuje bliski związek z lialh4, którego nazwy to aluminium i wodorek litowy, alaninian litu lub tetrahydroluminacja litu. Chociaż ma charakterystykę polimeru i metastabilność cieplną, występuje w siedmiu polimorfach o różnych morfologiach krystalicznych.
[TOC]
Struktura
Koordynacje
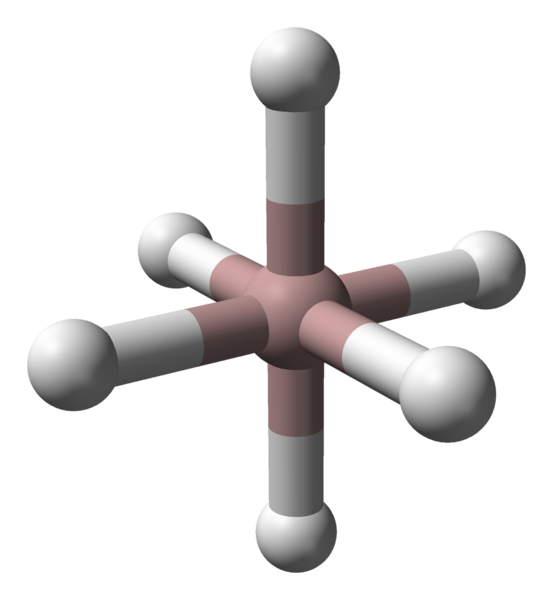
 Oktaedralna koordynacja kationów aluminiowych w krysztale ALH3. Źródło: Benjah-BMM27 / Public Domena.
Oktaedralna koordynacja kationów aluminiowych w krysztale ALH3. Źródło: Benjah-BMM27 / Public Domena. Niezależnie od rozważanego polimorfitu lub fazy krystalicznej, koordynacja między atomami aluminium i wodoru jest stała. Na przykład na górnym obrazie, podobnie jak na pierwszym obrazie, oktahedron koordynacyjny dla atomów aluminiowych (brązowa kula) pokazano na pierwszym obrazie.
Może ci służyć: prawa stechiometryczneKażdy atom jest otoczony sześć godzin, ustanawiając sześć linków al-H. Sposób, w jaki oktahedry są zorientowane w przestrzeni, zrobi różnicę strukturalną między jednym polimorfem a drugim.
Z drugiej strony każdy atom H jest skoordynowany z dwoma atomami AL, ustanawiając wiązanie Al-H-Al, które można uzasadnić łącznikiem typu 3C2E (3 centra-2 elektrony). Ten link jest odpowiedzialny za dołączenie do kilku ośmiedros ALH6 W całym krysztale Alano.
Izolowana cząsteczka
ALH3 Jest uważany za polimerowy z powodu sieci ALH6 które integrują szkło. Aby wyodrębnić poszczególną cząsteczkę Alano, konieczne jest zastosowanie niskich ciśnień w obojętnej atmosferze gazu szlachetnego. W ten sposób polimer pęka i uwalnia cząsteczki ALH3 trygonalnej płaskiej geometrii (analogiczna do BH3).
Z drugiej strony można zmniejszyć dwa ALH3 Aby uformować2H6, Jak w przypadku Diborano, B2H6. Jednak, aby to osiągnąć, wymagane jest zastosowanie stałego wodoru, więc może nie mieć dużej długoterminowej wartości przemysłowej lub komercyjnej.
Polimorfy
Alano lub ALH3 Jest w stanie utworzyć do siedmiu polimorfów: α, α ', β, γ, δ, ε i ζ, z których α jest najbardziej stabilny dla zmian temperatury. Α-alh3 Wyróżnia się morfologią sześcienną i sześciokątną strukturą krystaliczną. To zwykle jest produkt, w którym inne polimorfy są przekształcane, gdy cierpią destabilizacja termiczna.
Morfologia γ-alh3, Z drugiej strony wyróżnia się typem igły. Dlatego ALH3 Ciało stałe może zawierać mieszaninę więcej niż dwóch polimorfów i występować zróżnicowane kryształy do mikroskopu.
Nieruchomości
Wygląd fizyczny
Aluminiowy wodorek jest bezbarwnym lub białawym, krystalicznym wyglądem z tendencją do pokazywania kształtów igły.
Może ci służyć: kwas sulfonowy: struktura, nomenklatura, właściwości, zastosowaniaMasa cząsteczkowa
29.99 g/mol o 30 g/mol
Temperatura topnienia
150 ° C. Ale zaczyna pękać z 105 ° C.
Rozpuszczalność wody
Wysoki, a potem zareaguj z nią.
Rozpuszczalność
Nierozpuszczalne w rozpuszczalnikach dietyloeterowych i apolowych, takich jak benzen i pentan. Reaguje z alkoholami i innymi rozpuszczalnikami polarnymi.
Rozkład
ALH3 Jest podatny na rozkład z różnymi prędkościami w zależności od warunków zewnętrznych, morfologii i stabilności termicznej ich kryształów lub stosowania katalizatorów. Kiedy to się stanie, uwalnia wodór i przekształca się w metalowe glin:
2alh3 → 2Al + 3H2
W rzeczywistości ten rozkład, a nie problem, stanowi jeden z powodów, dla których ALANO jest uważany za interesujący w rozwoju nowych technologii energetycznych.
Formacja adduktu
Kiedy ALH3 Nie reaguje nieodwracalnie z rozpuszczalnikiem, ustanawia z nim addukt, to znaczy rodzaj kompleksu. Na przykład możesz utworzyć kompleks z trimetyloaminą, ALH3· 2n (cho3)3, Z tetrahydrofurano, ALH3· Thf lub z dietetykiem, ALH3· Et2ALBO. Ten ostatni był najbardziej znany, gdy synteza lub uzyskanie alano wprowadzono w 1947 r.
Uzyskanie
Pierwsze występy ALH3 Pochodzą z 1942 i 1947 r4 W medium dietylowym:
3Lialh4 + Alcl3+ NEt2O → 4Alh3 · NEt2O + 3LICL
Eteryczne rozwiązanie, ALH3 · NEt2Lub musiał się poddać rozczarowaniu, w celu wyeliminowania ET2Lub i zdobądź ALH3 czysty. Oprócz tego problemu LICL należy wyeliminować z medium produktów.
Zatem w latach 1950–1977 zaprojektowano nową syntezę w celu uzyskania lepszych wydajności ALH3, a także najczystsze substancje stałe i lepsze właściwości termiczne i morfologiczne. Modyfikując stosowane ilości, kroki i instrumenty, można sprzyjać uzyskaniu polimorfu nad drugim. Jednak α-alh3 Zazwyczaj jest to produkt większości.
Może ci służyć: Alilo: Allyic Unit, Carbocation, Radical, przykładyInne metody syntezy obejmują korzystanie z elektrochemii. Aby to zrobić, używana jest anoda aluminiowa i katoda platynowa. W anodzie przechodzi następująca reakcja:
3alh4- + Do3+ + NTHF → 4ALH3 · NTHF + 3E-
Podczas gdy w katodzie otrzymuje się metaliczny sód. Następnie ALH3 · NTHF ulega również rozczarowującym, aby wyeliminować THF i wreszcie uzyskać ALH3.
Aplikacje
Środek redukujący
ALH3 Służy do zmniejszenia niektórych funkcjonalnych grup związków organicznych, takich jak kwasy karboksylowe, ketony, aldehydy i estry. Praktycznie to, co robi, to dodać hydrogeny. Na przykład Ster można zmniejszyć do alkoholu w obecności grupy Nitro:
 Redukcja Ster z wodorkiem aluminiowym. Źródło: Ginger / Public Domena.
Redukcja Ster z wodorkiem aluminiowym. Źródło: Ginger / Public Domena. Zbiornik wodoru
Aluminiowy wodorek stanowi alternatywę, aby służyć jako zbiornik wodoru, a tym samym, aby móc go przenosić w urządzeniach obsługujących akumulatory wodorowe. Objętości uzyskane z H2 odpowiadają większej objętości podwójnej niż ALH3.
Mając ALH3, i rozkładając kontrolę, można zwolnić pewną pożądaną ilość H2 zawsze, gdy. Dlatego może być stosowane jako paliwo rakietowe i wszystkie te zastosowania energii, które mają na celu skorzystanie z spalania wodoru.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Aluminium wodorotu. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Aluminium wodorotu. Baza danych Pubchem., CID = 14488. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- J. Graetz i in. (2011). Aluminiowy wodorek jako materiał do magazynowania wodoru i energii: przeszłość, teraźniejszość i przyszłość. Elsevier b.V.
- Xu Bo i in. (2014). Przygotowanie i właściwości termiczne polimorfów wodordu studenckiego. doi.Org/10.1016/j.Próżnia.2013.05.009
- « Koncepcja wariacji liniowej, przykłady, rozwiązywane ćwiczenia
- Forma Ziemi i jej fizyczne i astronomiczne konsekwencje »

