Właściwości aromatyczne węglowodory, przykłady, zastosowania
- 1614
- 55
- Eliasz Dubiel
aromatyczne lub piaskowe węglowodory Są zbiorem związków organicznych, które składają się tylko z węgli i hydrogenów, i które charakteryzują się posiadaniem jednostek pierścieni benzenu w ich strukturach molekularnych.
Niektórzy, jak podkreśla jego imię, strzela słodkie i przyjemne zapachy; Powód, dla którego pierwsze organiczne chemikalia określane do nich jako aromatyczne. Na przykład gaz metanowy jest węglowodorem toaletowym; Podczas gdy toluen, lotna ciecz, przedstawia dość osobliwy i silny zapach.
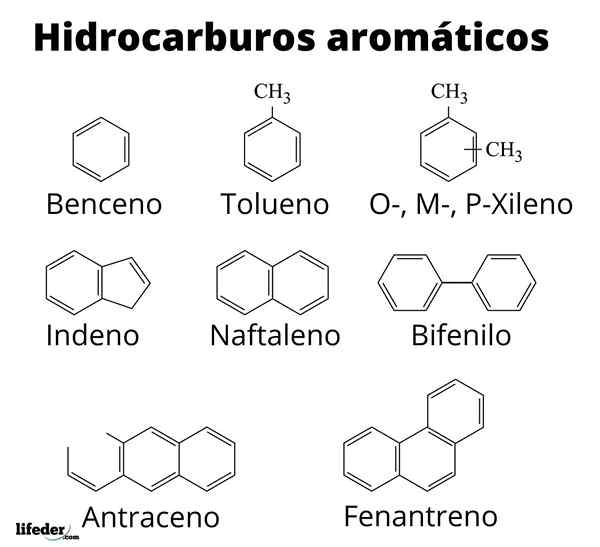
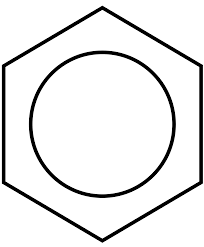
 Aromatyczne węglowodory są rozpoznawane przez jednostki pierścieni benncytenic
Aromatyczne węglowodory są rozpoznawane przez jednostki pierścieni benncytenic Na górnym obrazie mamy rodzaj sieci lub siatki złożonej z pierścieni benzenicznych. Zwróć uwagę na swoje geometrie sześciokątne i koło w środku. Koło to reprezentuje tak zwaną aromatyczność, która jest właściwością całkowicie chemiczną i niefizyczną, niezależną od zapachów tych węglowodorów.
Aromatyczne węglowodory należą do najważniejszych, ekstrahowanych lub wytwarzanych, oleju i minerałów węglowych. Benzen jest kamieniem węgielnym tych węglowodorów i ich zastosowań, ponieważ z niego wywodzi symfiny związków stosowanych jako surowiec do produkcji nawozów, tworzyw sztucznych, klejów, detergentów, perfum, leków itp.
[TOC]
Jak nazywane są węglowodory aromatyczne?
Pojedynczy pierścień benzenowy
W przypadku aromatycznych węglowodorów mamy osobliwość, że ich tradycyjne lub wspólne nazwy zwykle panują nad tymi rządzonymi przez nomenklaturę IUPAC.
Wszystkie zawierają pierścień benzenowy lub pierścień, który spełnia właściwość aromatyczności. Najprostsze można nazwać Benzene i względnych pozycji ich podstawników.
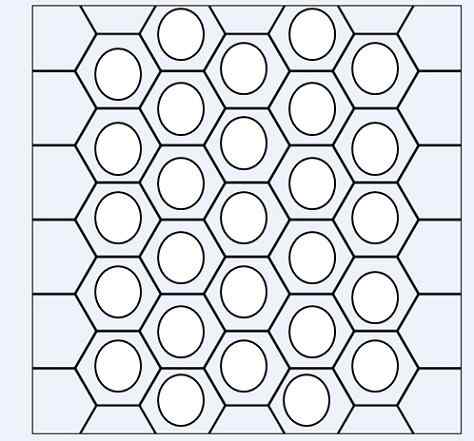
 Względne pozycje podstawników w pierścieniu benzenicznym dla cząsteczki dimetylobenzenu. Źródło: Gabriel Bolívar przez Molview.
Względne pozycje podstawników w pierścieniu benzenicznym dla cząsteczki dimetylobenzenu. Źródło: Gabriel Bolívar przez Molview. Rozważmy na przykład górny obraz. W trzech strukturach widzimy sześciokątny pierścień benzenu, który ma dwa podstawniki metylowe, Cho3. Zatem związek ten nazywa się dimetylobenzenem, ponieważ składa się z benzenu z dwoma metylo.
Może ci służyć: siarczan potasu (K2SO4): struktura, właściwości, zastosowania, syntezaOd lewej do prawej widzimy, że oddzielenie między nimi3 Staje się większy, co nie tylko wpływa na fizyczne właściwości cząsteczki, ale także modyfikuje ich odpowiednie nazwy. Aby je odróżnić, ponieważ wszystkie są nazywane dimetylobenzenem, stosuje się prefiks orto (o-), cel (m-) i dla (p-) (p-).
Dlatego, i znowu, od lewej do prawej mamy: orto-dimetylobenzen, meta-dimetylobenzen i parameterbenzen. Jednak tradycyjna nazwa tego związku to ksylen, więc nazwy stały się: orto-ksylen, meta-ksylen i para-ksylen.
Jeśli istnieją więcej niż dwa różne podstawniki, służy go do wyliczania węglowodanów zgodnie z tymi samymi zasadami nomenklatury, co dla wszystkich węglowodorów.
Wiele pierścieni
W przypadku aromatycznych węglowodorów z więcej niż jednym pierścieniem benzenicznym tradycyjne nazwy stają się jeszcze ważniejsze. Wynika to z faktu, że systematyczne nazwy opisujące ich struktury są kłopotliwe i trudne do zapamiętania. Rozważ przykład naftalenu:
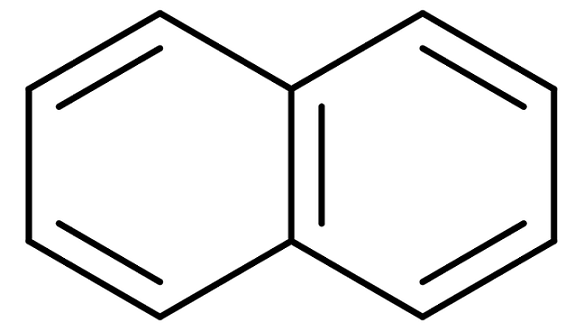 Struktura naftalenu
Struktura naftalenu Naftalen jest również znany komercyjnie jako naftaina lub biała kamfora. Jednak jego systematyczna nazwa to: biciclo [4,4,0] dec-1,3,5,7,9 pentan. I to tylko dla związku z dwoma połączonymi pierścieniami benzenicznymi; Nomenklatura staje się znacznie bardziej skomplikowana w przypadku związków z trzema lub więcej pierścieniami.
Właściwości aromatycznych węglowodorów
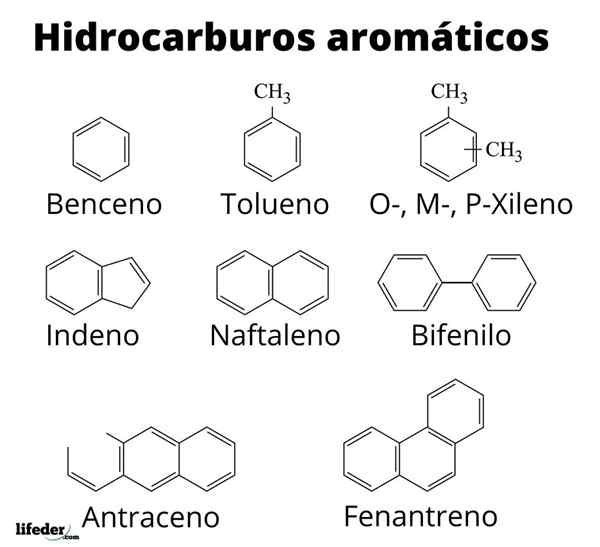 Struktura niektórych aromatycznych węglowodorów
Struktura niektórych aromatycznych węglowodorów Aromatyczność
Aromatyczne węglowodory zawierają pierścienie, które są posłuszne zasadom Huckela. Oznacza to, że ich pierścienie muszą mieć atomy z hybrydyzacją SP2, być tak płaski, jak to możliwe i miej wiele elokowanych elektronów π równych 4N + 2. Na przykład benzen jest aromatyczny, ponieważ ma 6 demokowanych elektronów dla N= 1 (4 · 1 + 2 = 6).
Wysokie relacje C/H
Relacje C/H dla aromatycznych węglowodorów są wysokie lub większe niż 1. Na przykład dla benzenu C6H6, Twój C/H jest równy 6/6 lub 1. Tymczasem dla naftalenu C10H8, Twój C/H jest równy 10/8 lub 1.25. Co to znaczy? Że te węglowodory są bardzo „gazowane” w porównaniu z innymi związkami.
Może ci służyć: kwas sulfonowy: struktura, nomenklatura, właściwości, zastosowaniaŻółte płomienie
Właśnie ze względu na ich wysokie relacje C/H, gdy aromatyczne węglowodory są spalone ogniem żółtymi płomieniami, iloczynem utworzonych cząstek węgla (sadza).
Reakcje zastępcze
Aromatyczne węglowodory mogą zastąpić ich atomy wodoru dowolnym innym podstawnikiem. Osiąga się to poprzez dwa rodzaje reakcji organicznych: aromatyczne podstawienie elektrofilowe (SEAR) lub aromatyczne podstawienie nukleofilowe (SNAR).
Zapachy
Aromatyczne węglowodory, jak sugeruje ich nazwa, charakteryzują się słodkimi lub mocnymi zapachami. Ta właściwość pozwoliła im je odróżnić w zasadzie od węglowodorów gazowych i niektórych parafinów chrząszczy.
Przykłady aromatycznych węglowodorów
Aromatyczne węglowodory, ściśle mówiąc, dotyczą tylko tych, które składają się z węgla i wodoru. Nie powinno być heteroátomos (lub, p, n, s itp.). Dlatego następujące przykłady, które zostaną wspomniane, pomijają związki, takie jak pirydyna, furano lub fenol.
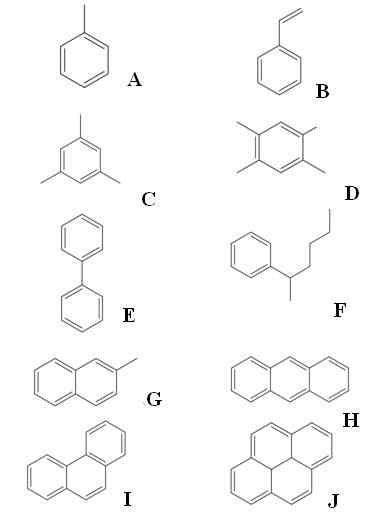 Przykłady aromatycznych węglowodorów. Źródło: Gabriel Bolívar przez Molview.
Przykłady aromatycznych węglowodorów. Źródło: Gabriel Bolívar przez Molview. Mamy dziesięć przykładów aromatycznych węglowodorów. Zauważ, że każdy ma przynajmniej jeden pierścień benzeniczny. Ich imiona to:
Odp.: Tolueen
B: rozciągnij
C: Mesitileno
D: Późno
E: bifenyl
F: 2-fenilheksan
G: 2-metyloaftalen
H: Anthracen
I: Fenantreno
J: Pireno
Spośród nich toluene ma największą wartość przemysłową.
Aplikacje/zastosowania
Większość zastosowań aromatycznych węglowodorów składa się z serwowania jako surowca do syntezy lub produkcji o wysokiej wartości komercyjnej. Prawie wszystkie z nich zaczynają się od benzenu, który podlega kilku reakcjom organicznym w celu uzyskania funkcjonalnych pochodnych.
Włókna i tworzywa sztuczne
 Benzen
Benzen Z benzenu jest cykloheksan, który następnie jest przekształcany w inne związki w celu syntezy nylonu 6 lub nylonu 66. Z drugiej strony odcinek można również uzyskać z benzenu, który składa się z monomeru polistyrenowego. Tak więc mamy polimery niezbędne do produkcji włókien i tworzyw sztucznych.
Może ci służyć: Energia aktywacjiEpoksydowa żywica
Z benzenu, również bisfenol A można zsyntetyzować, z którymi występują różne drogi syntezy, występują żywice epoksydowe, klej, kleje, a nawet obrazy.
Detergenty
Alkybentes z długimi łańcuchami bocznymi służą do produkcji detergentów; Wśród nich alkybenzeosulfonaty.
TNT
Od toluenu możesz wyprodukować TNT: trinitrotolueen, jeden z najbardziej znanych materiałów wybuchowych.
Kwas benzoesowy
Od toluenu kwas benzoesowy uzyskuje się jako pochodzący, niezbędny związek dla preparatów wielu perfum, leków i żywności.
Rozpuszczalniki
Benzen, toluen i Xileno (BTX), są najczęściej stosowanymi rozpuszczalnikami organicznymi w badaniach nad ropą.
Benzyna
Aromatyczne węglowodory są również częścią składu benzyny, z główną rolą podnoszenia indeksu oktanowego lub oktanowego.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Związek aromatyczny. Źródło: w:.Wikipedia.org
- Ed Vitz i in. (8 września 2020). Aromatyczne węglowodory. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wyman Elizabeth. (2020). Aromatyczne węglowodory: definicja, przykład i użycie. Badanie. Odzyskane z: Study.com
- Boluda, c. J., Macías, m., I González Marrero, J. (2019). Złożoność chemiczna benzyny samochodowej. Nauka, inżynieria i zastosowania,2(2), 51-79. Doi: doi.Org/10.22206/Cyap.2019.V2i2.PP51-79
- « Ochrona zasady momentu liniowego, przykładów, ćwiczeń.
- Modlitwy z G przykładami i zasadami użytkowania »

