Struktura, właściwości i zastosowania heptano (C7H16)
- 3585
- 457
- Pani Gilbert Stolarczyk
On heptano Jest to związek organiczny, którego wzór chemiczny to c7H16 i obejmuje dziewięć izomerów strukturalnych, z których najbardziej znani jest liniowy. Jest to węglowodór, w szczególności alkan lub parafina, która jest w większości laboratoriów chemii organicznej, czy to nauczania, czy badań.
W przeciwieństwie do innych rozpuszczalników parafinowych, heptano ma niższą zmienność, co przynosi jego stosunkowo bezpieczniejsze zastosowanie; Ilekroć nie ma źródła ciepła otaczającego opary i jest ono przepracowane w dzwonie ekstraktora. Odsuwając swoją łatwopalność, jest to wystarczająco bezwładny związek, który służy jako środek reakcji organicznych.
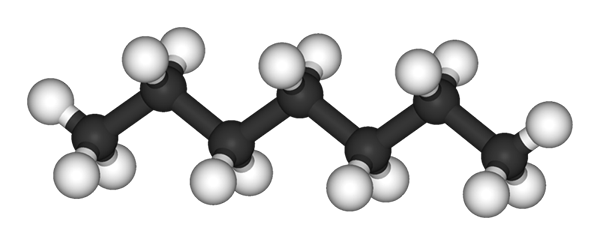
 Cząsteczka n-heptano reprezentowana przez model sfery i słupków. Źródło: Ben Mills i Jynto [domena publiczna]
Cząsteczka n-heptano reprezentowana przez model sfery i słupków. Źródło: Ben Mills i Jynto [domena publiczna] Na górnym obrazie masz strukturę N-heptano, liniowy izomer wszystkich heptanów. Ponieważ jest to najczęstszy izomer i o większej wartości komercyjnej, a także najłatwiejszy do syntezy, zwykle jest to, że termin „heptano” odnosi się wyłącznie do N-heptano; o ile nie zaznaczono inaczej.
Jednak w butelkach tego ciekłego związku określono, że zawiera on N-heptano. Muszą odkryć wewnątrz dzwonka ekstraktora i ostrożnie wykonać pomiary.
Jest to doskonały rozpuszczalnik tłuszczów i olejków, więc jest często używany podczas esencji roślinnych lub innych naturalnych produktów.
[TOC]
Struktura
N-heptan i jego interakcje międzycząsteczkowe
Jak widać na pierwszym zdjęciu, cząsteczka N-heptano jest liniowe, a ze względu na chemiczną hybrydyzację jego atomów węgla łańcuch przyjmuje kształt zygzakowca. Ta cząsteczka jest dynamiczna, ponieważ jej wiązania C-C mogą się obracać, co sprawia, że łańcuch składa się nieznacznie pod różnymi kątami. Przyczynia się to do interakcji międzycząsteczkowych.
Może ci służyć: PI LinkOn N-Heptano jest apolarną, hydrofobową cząsteczką, a zatem jej interakcje oparte są na siłach dyspersyjnych Londynu; Są to te, które zależą od masy cząsteczkowej związku i jego obszaru kontaktowego. Dwie cząsteczki N-heptan.
Te interakcje są wystarczająco skuteczne, aby utrzymać cząsteczki N-Heptano spójne w cieczy, która gotuje się w temperaturze 98 ° C.
Izomery
 Dziewięć izomerów heptan. Źródło: Steffen 962 [domena publiczna]
Dziewięć izomerów heptan. Źródło: Steffen 962 [domena publiczna] Początkowo powiedziano, że formuła C7H16 reprezentował w sumie dziewięć izomerów strukturalnych, będąc N-heptan najbardziej odpowiedni (1). Pozostałe osiem izomerów pokazano na górnym obrazie. Zwróć uwagę na nagie oko, że niektóre są bardziej rozgałęzione niż inne. Od lewej do prawej, zaczynając od góry, mamy:
(2): 2-metyloheksan
(3): 3-metyloheksan, który składa się z pary enancjomerów (A i B)
(4): 2,2-dimetylopentano, znane również jako neoheptano
(5): 2,3-dimetylopentano, ponownie z parą enancjomerów
(6): 2,4-dimetylopentano
(7): 3.3-dimetylopentano
(8): 3-etylopentan
(9): 2,2,3-trimetylobutan.
Każdy z tych izomerów ma niezależne właściwości i zastosowania N-heptano, zarezerwowane bardziej niż cokolwiek innego dla obszarów syntezy ekologicznej.
Właściwości hepthane
Wygląd fizyczny
Bezbarwny ciecz z zapachem podobnym do benzyny.
Masa cząsteczkowa
100 205 g/mol
Temperatura topnienia
-90 549 ° C, stając się kryształem molekularnym.
Punkt wrzenia
98,38 ºC.
Ciśnienie pary
52,60 atm w temperaturze 20 ° C. Zwróć uwagę, jak wysokie jest ciśnienie pary, mimo że jest mniej lotne niż inne rozpuszczalniki parafinowe, takie jak heksano i pentan.
Gęstość
0,6795 g/cm3. Z drugiej strony opary heptano są 3,45 razy gęste niż powietrze, co oznacza, że ich opary będą trwać w przestrzeniach, w których niewielki rozlanie płynnego.
Może ci służyć: kwas mrówkowy (HCOOH)Rozpuszczalność wody
Heptan do bycia hydrofobowym związkiem ledwo rozpuszcza się w wodzie, powodując roztwór o stężeniu 0,0003% w temperaturze 20 ° C.
Rozpuszczalność w innych rozpuszczalnikach
Hepthan jest mieszany z tetrachlorkiem węglowym, etanolem, acetonem, eterem olejowym i chloroformem.
Współczynnik załamania światła (ND)
1 3855.
Breja
0,389 MPa · s
Pojemność cieplna
224,64 j/k · mol
punkt zapłonu
-4 ° C
Temperatura samo -kierunkowego
223 ° C
Napięcie powierzchniowe
19,66 mn/m 25 ºC
Ciepło spalania
4817 kJ/mol.
Reaktywność
Opary hepthane, gdy są blisko źródła ciepła (płomień), reagują egzotermiczne i energicznie z tlenem powietrza:
C7H16 + 11o2 => 7co2 + 8h2ALBO
Jednak poza reakcją spalania heptan jest dość stabilnym płynem. Brak reaktywności wynika z faktu, że ich łącza C-H są trudne do złamania, więc nie jest podatne na podstawienia. Nie jest również bardzo wrażliwy na silne środki utleniające, pod warunkiem, że w pobliżu nie ma ognia.
Największe niebezpieczeństwo heptano reprezentuje jego wysoka zmienność i łatwopalność, więc istnieje ryzyko pożaru, jeśli zostanie rozlane w gorących miejscach.
Aplikacje
Rozpuszczalnik i połowa reakcji
 Hepthane jest doskonałym rozpuszczalnikiem do rozpuszczania olejów i tłuszczów. Źródło: Pxhere.
Hepthane jest doskonałym rozpuszczalnikiem do rozpuszczania olejów i tłuszczów. Źródło: Pxhere. Hydrofobowy charakter heptano jest doskonałym rozpuszczalnikiem do rozpuszczenia olejów i tłuszczów. W tym aspekcie był używany jako odtłuszczający. Jednak jego największym zastosowaniem polega na stosowaniu jako rozpuszczalnik ekstraktora, ponieważ rozpuszcza składniki lipidowe, a także inne związki organiczne próbki.
Na przykład, jeśli chcesz wyodrębnić wszystkie elementy mielonej kawy, byłby macered w heptanie zamiast wody. Ta metoda i jej odmiany zostały zaimplementowane ze wszystkimi rodzajami nasion, dzięki których uzyskano esencje roślinne i inne naturalne produkty.
Może ci służyć: jednolita komórka: właściwości, czerwone stałe i typyHeptan, który jest naturalnie bezbarwny, zostanie farbowany od koloru wydobytego oleju. Następnie jest to obracane, aby wreszcie mieć objętość oleju tak czystego, jak to możliwe.
Z drugiej strony niewielka reaktywność heptanu pozwala również być opcją przy rozważaniu sposobu reakcji na przeprowadzenie syntezy. Będąc dobrym rozpuszczalnikiem związków organicznych, gwarantuje, że odczynniki pozostają w roztworze i oddziałują ze sobą, gdy reagują.
Środek wytrących
W chemii oleju powszechną praktyką jest wytrącanie asfaltnom surowej próbki poprzez dodanie heptano. Ta metoda pozwala na badanie stabilności różnych surowych i określanie, jak podatna jest jej zawartość asfaltenu.
Oktan
Heptan został wykorzystany jako paliwo ze względu na dużą ilość ciepła, które oferuje, gdy się spala. Jednak w odniesieniu do silników samochodowych byłoby szkodliwe dla jego działania, gdyby był użyty wyłącznie. Ponieważ pali się bardzo wybuchowo, służy do zdefiniowania 0 w oktanowej skali benzyny.
Benzyna zawiera wysoki odsetek heptano i innych węglowodorów do wyrównania oktanu do znanych wartości (91, 95, 87, 89 itp.).
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Heptan. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Baza danych heptanu Pubchem. CID = 8900. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elsevier b.V. (2020). Heptan. Scientedirect. Pobrano z: Scientedirect.com
- Bell Chem Corp. (7 września 2018 r.). Przemysłowe zastosowania heptanu. Odzyskany z: Bellchem.com
- Andrea Kropp. (2020). Heptan: struktura, zastosowania i formuła. Badanie. Odzyskane z: Study.com
- « Skondensowana formuła Czym jest i przykłady (metan, etan, glukoza ...)
- Mechaniczne wzory energii, koncepcja, typy, przykłady, ćwiczenia »

