Skondensowana formuła Czym jest i przykłady (metan, etan, glukoza ...)
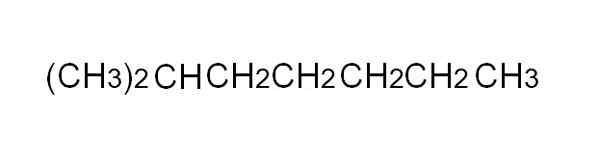
- 2410
- 111
- Matylda Duda
skondensowana formuła Jest to czysto tekstowa reprezentacja cząsteczki, w której pominięto linki. Jego celem jest wiedzieć, jakie jest zamawianie atomów. Ogólnie cząsteczki liniowe lub rozgałęzione mają kondensowane wzory, z wyjątkiem cyklicznych lub tych, które są wysoce rozgałęzione.
W chemii organicznej zwykle występuje pomieszanie tego, jaka jest różnica między tym wzorem a molekularną. W rzeczywistości często uważa je za synonimy. Tymczasem w chemii nieorganicznej wzory molekularne są stosowane więcej, ponieważ w większości przypadków kowalencyjne związki słusznie opisują; Jak woda, h2ALBO.
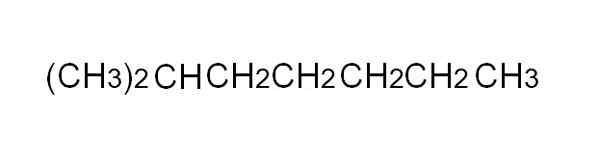 Skondensowana wzór 2-metyloheptano. Źródło: Gabriel Bolívar.
Skondensowana wzór 2-metyloheptano. Źródło: Gabriel Bolívar. [TOC]
Jaka jest skondensowana formuła?
Aby go wygodniej zdefiniować, kondensowana formuła jest uproszczoną reprezentacją częściowo opracowanej. Pisanie prostych linków nie jest konieczne, ani nie powinien obejmować więcej niż jednego wiersza w tekście. Na przykład 2-metyloheptano, rozgałęziony alkan, może być reprezentowany w tej samej linii, co na górnym obrazie.
Formuły skondensowane są przydatne do reprezentowania niektórych cząsteczek bez ich rysowania. Jest to doskonałe, gdy zapisane są równania chemiczne, gdy cząsteczki cykliczne lub bardzo rozgałęzione nie uczestniczą. Okaże się, że te wzory uciekają się do nawiasów w celu dalszego uproszczenia reprezentacji cząsteczki.
Przykłady
Metan
Metan jest jedynym związkiem chemicznym, który ma pojedynczy wzór: CH4. Odpowiada to jednocześnie empiryczne, molekularne, skondensowane i półprodukcyjne. Dlatego wiele razy, aby zaoszczędzić zamieszanie między wszystkimi tymi pojęciami, ludzie wolą odwołać.
Etano
Estano ma wzór molekularny C2H6. Zamiast tego skondensowana formuła to Cho3Ch3. Zauważ, że link C-C i linki C-H są pominięte. Chodzi o to, aby móc napisać formułę, jakby to było „słowo”, bez konieczności rysowania pasków lub rysowania struktur.
Może ci służyć: piknometrZ definicji wzór molekularny to C2H6 i nie ch3Ch3; Jednak w przypadku prostych cząsteczek oba formuły są zwyczajowe w wymianie, chociaż nadal jest to nieprawidłowe. Jest to punkt rozbieżności między kilkoma źródłami, w których istnieją najwyraźniej w tym względzie.
Glukoza i fruktoza
Oto przykład, w którym błąd jest natychmiast obserwowany, gdy chcesz wymienić wzór molekularny dla kondensatu.
Moment słodki, glukozy i fruktozy mają ten sam wzór molekularny: C6H12ALBO6, I dlatego nie służy to do ich rozróżnienia. Natomiast formuły strukturalne i częściowo rozwinięte ustalają różne cząsteczki w zasięgu wzroku.
Jednak glukoza lub fruktoza mają skondensowaną formułę. Dzieje się tak, ponieważ niezależnie od ich reprezentacji lub projekcji ich struktury nie można zapisać w tej samej linii; A przynajmniej w sposób przyjemny i prosty w oczach czytelnika.
Butan
Butano ma wzór molekularny C4H10. Ma dwa izomery: liniowy, N-Butano i rozgałęziony, 2-metylopropan. Oba mogą być reprezentowane przez ich skondensowane formuły. On N-Butano to rozdz3Ch2Ch2Ch3 lub Ch3(Ch2)2Ch3, A 2-metylopropan to cho3CH (rozdz3)2 lub (rozdz3)3Ch.
W 2-metylopropanu mamy grupę chourowaną trzy Cho3. Jego dwa wzory są prawidłowe, a nawiasy są używane do podkreślenia konsekwencji, a subskrypcja jest wskaźnikiem tego, ile grup tworzy tę gałąź.
Etanol
Etanol ma skondensowaną formułę CH3Ch2Oh. Zwróć uwagę, jak bardzo przypomina swoją pół -rozwiniętą formułę: CH3-Ch2-Oh. W ten sam sposób, w jaki odbywa się to z Propanol, Cho3Ch2Ch2Och, The N-Butanol, rozdz3Ch2Ch2Ch2Aha, i ze wszystkimi innymi alkoholi.
Może ci służyć: fosforan sodu: struktura, właściwości, synteza, zastosowaniaJeśli mają gałąź, zostanie ona wskazana w nawiasie po prawej stronie atomu, z którym jest powiązany. Na przykład 2-metylobutanol można zapisać jako: CH3Ch2CH (rozdz3) Ch2Oh. Zauważ, że w przypadku wielu cząsteczek zaczyna być wygodniej.
Pentano
Izomer liniowy Pentana, N-Pentano, łatwo jest przedstawić skondensowaną formułę: Cho3Ch2Ch2Ch2Ch3. Ten wzór można również uprościć za pomocą nawiasów: CH3(Ch2)3Ch3, wskazując, że między dwoma CH3 Są trzy CH2.
Pozostałe dwa izomery Pentan są jednak nieco bardziej skomplikowane: CH3Ch2CH (rozdz3)2, Dla 2-metylobutanu i c (ch3)4 Dla 2.2-dimetylopropanu lub neopantu. Zauważ, że atom węgla po lewej stronie nawiasu jest tym, który tworzy linki do podstawników lub konsekwencji.
Oktan
Liniowy izomer oktanu, N-Oktan, ze względu na swoją długość, teraz należy przedstawić swoją skondensowaną formułę jako Cho3(Ch2)6Ch3. W tym momencie powinno być coś czystego skondensowanych formuł: starają się zaoszczędzić czas, reprezentując cząsteczki lub związki, bez pisania na papierze.
Cykloheksan
Przypadek cykloheksanu jest podobny do przypadku glukozy i fruktozy: formalnie brakuje skondensowanego wzoru dla bycia cyklicznym związkiem. Sposobem na reprezentowanie, byłby: (CH2)6, co oznacza, że sześć grup Cho2 Muszą być powiązane, będąc możliwe tylko wtedy, gdy zamkną się na sześciokątnym pierścieniu. Lepiej jednak narysować pierścień.
Aceton
Aceton przedstawia osobliwość posiadania grupy karbonylowej, C = O. Dlatego, aby napisać twoją skondensowaną formułę, mamy trzy opcje: (CH3)2Co, rozdz3C (o) CH3 lub Ch3(C = O) CH3.
Może ci podać: kawa kwas: struktura, właściwości, biosynteza, zastosowaniaW rzeczywistości w większych cząsteczkach grupa karbonylowa jest zwykle reprezentowana jako (O), biorąc pod uwagę, że atom węgla po lewej jest ten, który tworzy podwójne wiązanie z tlenem, C = O.
Kwas octowy
Skondensowana wzór kwasu octowego to Cho3Cooh o ch3WSPÓŁ2H. Oto ważny punkt: grupy funkcjonalne napisane w tej samej linii są częściami skondensowanej formuły. Tak było w przypadku etanolu i acetonu, a także dotyczy tolisów (-SH), aldehydo (-cho) estry (-CO2R o -coor) i aminy (-nh2).
Ogólny komentarz
Istnieje wiele zamieszania między formułami molekularnymi i skondensowanymi. Być może dzieje się tak, ponieważ same te reprezentacje już stanowią przybliżony obraz cząsteczki, więc uważamy, że jest to wzór molekularny.
Również formuły, takie jak C6H12ALBO6 Są również uważane za kondensat, ponieważ są uproszczone, „kondensuje” cząsteczkę w atomach i indeksach dolnych. Dlatego powszechne jest widzenie, jak wspomniane są dwa formuły, tak jakby były synonimami.
W wielu źródłach, w tym artykułach Wikipedii, terminy „wzór chemiczny” są używane w odniesieniu do molekularnych (typ C6H12ALBO6 i inni) i „formuła” w odniesieniu do kondensatu.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (18 listopada 2019). Definicja formuły skondensowanej w chemii. Odzyskane z: Thoughtco.com
- James Ashenhurst. (11 grudnia 2019 r.). Skondensowane formuły: rozszyfrowanie tego, co oznaczają plecy. Master Organic Chemistry. Odzyskane z: MastorganicChemistry.com
- Copolingenieria. (2 maja 2016 r.). Formuła empiryczna, strukturalna i kondensatowa. Źródło: chemioteCablog.WordPress.com
- Wprowadzenie do chemii: ogólne, organiczne i biologiczne. (S.F.). Skondensowane formuły strukturalne i kątowe. Odzyskane z: 2012 książki.Lardbucket.org

