Charakterystyka glutationu, struktura, funkcje, biosynteza
- 1288
- 154
- Estera Wojtkowiak
On Glutation (Gsh) Jest to niewielka cząsteczka tripeptydowa (z tylko trzema odpadami nie -białko), która uczestniczy w wielu zjawiskach biologicznych, takich jak mechanika enzymatyczna, biosynteza makrocząsteczek, metabolizm pośredniczący, toksyczność tlenu, transport wewnątrzkomórkowy itp.
Ten mały peptyd, obecny u zwierząt, w roślinach i niektórych bakteriach, jest rozważany jako ”bufor" -reduktor tlenku, ponieważ jest to jeden z głównych związków o niskiej masie cząsteczkowej, który zawiera siarkę i brakuje toksyczności związanej z resztami cysteiny.
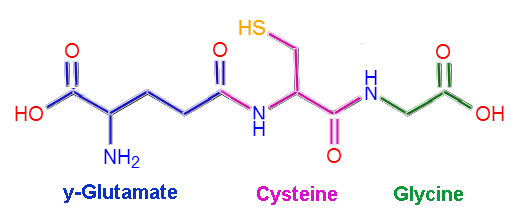
 Struktura molekularna glutationu (źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura molekularna glutationu (źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Niektóre choroby u ludzi wiązały się z niedoborem określonych enzymów metabolizmu glutationu, co wynika to z ich wielu funkcji w utrzymaniu homeostazy ciała ciała.
Niedożywienie, stres oksydacyjny i inne patologie cierpiące przez ludzi mogą być dowodowe jako drastyczne spadek glutationu, więc czasami jest to dobry wskaźnik stanu zdrowia układów ciała.
W przypadku roślin w ten sam sposób glutation jest niezbędnym czynnikiem dla jego wzrostu i rozwoju, ponieważ spełnia również funkcje na wielu szlakach biosyntetycznych i jest niezbędny do detoksykacji komórek i wewnętrznej homeostazy, gdzie działa jako potężny przeciwutleniacz.
[TOC]
Charakterystyka
Pierwsze badania przeprowadzone w odniesieniu do subkomórkowej lokalizacji glutationu wykazały, że występuje w mitochondriach. Następnie zaobserwowano go również w regionie odpowiadającym matrycy jądrowej i peroksysomom.
Obecnie wiadomo, że przedział, w którym jego stężenie jest bardziej obfite w cytosolu, ponieważ aktywnie wytwarzane jest i transportowane do innych przedziałów komórkowych, takich jak mitochondria.
W komórkach ssaków stężenie glutationu znajduje się w zakresie milimoli, podczas gdy w osoczu krwi jego zmniejszony kształt (GSH) występuje w stężeniach mikromolarnych.
To wewnątrzkomórkowe stężenie przypomina stężenie glukozy, potasu i cholesterolu, niezbędne elementy struktury komórkowej i metabolizmu.
Niektóre organizmy mają cząsteczki analogowe lub warianty glutationu. Patozoan pasożyty, które wpływają na ssaki, mają formę znaną jako „tripanotion”, aw niektórych bakteriach związek ten zastępuje się innymi siarkowymi cząsteczkami, takimi jak tioiulrafat i glutamilachysteina.
Niektóre gatunki roślin mają, oprócz glutationu, homologicznych cząsteczek, które mają marnotrawstwo innych niż glicyna na końcu C-końcowym (homoglutacja), i które charakteryzują się prezentowaniem funkcji podobnych do przedmiotów o tripéptide.
Pomimo istnienia innych związków podobnych do glutationu w różnych organizmach, jest to jedna z „tuszów”, która jest w większym stężeniu wewnątrzkomórkowym.
Wysoka zależność, która zwykle istnieje między zredukowaną postacią (GSH) a postacią utlenioną (GSSG) glutationu, jest kolejną charakterystyczną cechą tej cząsteczki.
Struktura
Gutacja lub L-German-glutamil-cisteinylo-glicyna, jak sama nazwa wskazuje, składa się z trzech odpadów aminokwasowych: L-glutaminianu, L-cysteiny i glicyny. Reszty cysteiny i glicyny wiążą się ze sobą poprzez wspólne łącza peptydowe, to znaczy między grupą α-karboksylową jednego aminokwasu a grupą α-amino drugiej.
Jednak związek między glutaminianem a cysteiną nie jest typowy dla białka, ponieważ występuje między częścią γ-karboksylową grupy R glutaminianu a grupą α-aminową cysteiny, więc ten związek nazywa się γ połączyć.
Ta mała cząsteczka ma masę molową nieco ponad 300 g/mol, a obecność łącza γ wydaje się być kluczowa dla odporności tego peptydu przeciwko działaniu wielu enzymów aminopeptydazy.
Może ci służyć: solidarność między gatunkamiFunkcje
Jak wspomniano, glutation jest białkiem, które uczestniczy w licznych procesach komórkowych zwierząt, roślin i niektórych prokariotów. W tym sensie ogólny udział można podkreślić w:
-Procesy syntezy i degradacji białek
-Tworzenie prekursorów rybonukleotydowych DNA
-Regulacja aktywności niektórych enzymów
-Ochrona komórek w obecności reaktywnych form tlenu (ROS) i innych wolnych rodników
-Transdukcja sygnału
-Ekspresja genetyczna i w
-Zaprogramowana apoptoza lub śmierć komórek
Coenzyme
Ustalono również, że glutation działa jako koenzym w wielu reakcjach enzymatycznych i że część jego znaczenia jest związana z tym, co ma zdolność do transportu aminokwasów w postaci aminokwasów γ-glutamilowych wewnątrzkomórkowych.
Glutation, który może pozostawić komórkę (która to robi w jej zmniejszonej postaci) jest w stanie uczestniczyć w reakcjach ograniczania tlenku w pobliżu błony plazmatycznej i otaczającego środowiska komórkowego, które chroni komórki uszkodzenia przed różnymi rodzajami środków utleniania.
Magazynowanie cysteiny
To Tripétido działa również jako źródło magazynowania cysteiny i przyczynia się do utrzymania zmniejszonego stanu białek grup sulfhydhyl.
Fałdowanie białek
Podczas udziału w składaniu białek wydaje się, że ma to ważną funkcję jako czynnik redukujący mosty disiarczkowe, które były niewłaściwie utworzone w strukturach białkowych, co zwykle jest spowodowane narażeniem na środki utleniające, takie jak tlen, nadtlenek wodoru, peroksynitrit i niektóre nadtlenki.
Funkcja w erytrocytach
W erytrocytach zmniejszona glutation (GSH) wytwarzana przez enzym peroksydazę glutationu, która wytwarza utlenioną wodę i glutation (GSSG).
Rozkład nadtlenku wodoru, a zatem zapobieganie jego akumulacji w erytrocytach, przedłuża czas żywotności tych komórek, ponieważ unika uszkodzenia oksydacyjnego, które mogą wystąpić w błonie komórkowej i które mogą zakończyć się hemolizą.
Metabolizm ksenobiotyczny
Glutation jest również ważnym bohaterem w metabolizmie ksenobiotycznym, dzięki działaniu enzymu glutationowego S-transferazy S, które generują koniugaty glutationowe, które mogą być metabolizowane wewnątrzkomórkowo.
To jest mądre.
Stan oksydacyjny komórek
Ponieważ glutation istnieje w dwóch postaci. Jeśli stosunek GSH/GSSG jest większy niż 100, komórki są uważane za zdrowe, ale jeśli jest blisko 1 lub 10, może to być wskaźnik, że komórki są w stanie stresu oksydacyjnego.
Biosynteza
Glutatia Tridyde jest syntetyzowana wewnątrz komórkową, zarówno roślin, jak i zwierząt, przez działanie dwóch enzymów: (1) syntetaza γ-glutamilcistiny i (2) syntaza glutation (syntetaza GSH), podczas gdy jej degradacja lub „rozkład” zależy od działania enzymu γ-glutamil.
W organizmach roślinnych każdy z enzymów jest kodowany przez pojedynczy gen i defekty w dowolnym białku lub ich genach kodujących może powodować śmiertelność w zarodkach.
Może ci służyć: filogenezaW ludziach, podobnie jak u innych ssaków, główne miejsce syntezy i eksportu pytania glutationu.
Synteza Novo glutationu, ich regeneracji lub recyklingu, wymagają energii z ATP.
Zmniejszony glutation (GSH)
Zmniejszony glutation wywodzi się z aminokwasów glicyny, glutaminianu i cysteiny, jak już wspomniano, a jej synteza rozpoczyna się od aktywacji (przy użyciu ATP) grupy γ-karboksylowej glutaminianu (grupy R), aby utworzyć pośredniki fosforanu acylowego, który jest atakowany przez grupę α-aminową cysteiny.
Ta pierwsza reakcja kondensacyjna dwóch aminokwasów jest katalizowana przez syntetazę γ-glutamilcistein i zwykle ma na niej wpływ wewnątrzkomórkowy dostępność glutaminianu i cysteiny aminokwasów i cysteiny.
W ten sposób utworzony dipéptide jest następnie kondensowany cząsteczką glicyny dzięki działaniu syntazy GSH. Podczas tej reakcji występuje również aktywacja ATP grupy α-karboksylowej cysteiny.
Utleniony glutation (GSSG)
Kiedy zmniejszony glutation uczestniczy w reakcjach ograniczania tlenku, utleniona postać składa się z dwóch cząsteczek glutationu przyłączonych do siebie przez mosty disulfurowe; Z tego powodu zardzewiała forma jest skrócona z akronimem „GSSG”.
Tworzenie utlenionego gatunku glutationu zależy od enzymu znanego jako ale peroksydaza GSh lub peroksydaza GSH, która jest peroksydazą zawierającą selenocysteinę (resztę cysteinową, która zamiast mieć atom siarki, ma w niej selenium) Umieść zasób.
Połączenie między utlenionymi i zredukowanymi formami jest podawane dzięki udziałowi reduktazy GSSG lub glutationu reduktazy.
Korzyści z Twojego spożycia
Glutation można podawać doustne, miejscowe, dożylne, donosowe lub nebulizowane, w celu zwiększenia ich ogólnoustrojowego stężenia u pacjentów cierpiących na stres oksydacyjny, na przykład.
Rak
Badania przeprowadzone w odniesieniu do doustnego podawania glutationu sugerują, że jego spożycie może zmniejszyć ryzyko stanu raka jamy ustnej i że, podawane z oksydacyjnymi chemioterapeutykami, zmniejsza negatywny wpływ leczenia pacjentów z rakiem.
HIV
Ogólnie rzecz biorąc, pacjenci zainfekowani nabytym wirusem niedoboru odporności (HIV) mają wewnątrzkomórkowe niedobory glutationu zarówno w czerwonych krwinkach, jak i komórkach T i monocytach, które warunkuje ich prawidłowego funkcjonowania.
W badaniu przeprowadzonym przez Morrisa i współpracowników wykazano, że podaż glutationu do makrofagów od pacjentów z HIV znacznie poprawiła funkcję tych komórek, szczególnie w obliczu infekcji oportunistycznymi patogenami M. gruźlica.
Aktywność mięśni
Inne badania dotyczą poprawy skurczowej aktywności mięśni, obrony przeciwutleniającej i uszkodzeń oksydacyjnych spowodowanych w odpowiedzi na niedokrwienie/zmiany reperfuzyjne po podaniu doustnym GSH podczas treningu oporności fizycznej.
Patologie wątroby
Z kolei uważano, że jego dożylne spożycie lub podawanie ma funkcje w zapobieganiu postępowi niektórych rodzajów raka i zmniejszeniu uszkodzeń komórek, które występują w wyniku niektórych patologii wątroby.
Może ci służyć: niezbędne kwasy tłuszczowe: funkcje, znaczenie, nomenklatura, przykładyPrzeciwutleniacz
Chociaż nie wszystkie zgłoszone badania przeprowadzono u ludzi, ale zwykle są to testy w modelach zwierzęcych (ogólnie mysich), wyniki uzyskane w niektórych badaniach klinicznych zapewniają skuteczność egzogennego glutationu jako przeciwutleniacza.
Z tego powodu jest stosowany w leczeniu zaćmy i jaskry, jako produkt „przeciwstarzeniowy”, w leczeniu zapalenia wątroby, licznych chorób serca, utraty pamięci i do wzmocnienia układu odpornościowego oraz do oczyszczenia po Zatrucie metalami ciężkimi i narkotykami.
"Wchłanianie"
Glutathión podawany egzogenenie nie może wejść do komórek. Dlatego bezpośrednim wpływem podawania (doustnego lub dożylnego) tego związku jest wzrost stężenia wewnątrzkomórkowego GSH dzięki wkładowi niezbędnych aminokwasów w ich syntezy, które można skutecznie przetransportować do cytosolu.
Skutki uboczne
Chociaż uważa się, że spożycie glutationu jest „bezpieczne” lub nieszkodliwe, przeprowadzono niewystarczające badania dotyczące ich skutków ubocznych.
Jednak spośród kilku zgłoszonych badań wiadomo, że może mieć negatywne skutki wynikające z interakcji z innymi lekami i które mogą być szkodliwe dla zdrowia w różnych kontekstach fizjologicznych.
Jeśli jest przyjmowane w perspektywie długoterminowej, wydaje się, że poziomy cynku działają w nadmiernym spadku.
Bibliografia
- Allen, J., & Bradley, r. (2011). Wpływ doustnego glutationu. Dziennik medycyny alternatywnej i komplementarnej, 17(9), 827-833.
- Conklin, k. DO. (2009). Przeciwutleniacze dietetyczne podczas chemioterapii raka: wpływ na skuteczność chemioterapeutyczną i rozwój skutków ubocznych. Odżywianie i rak, 37(1), 1-18.
- Meister, a. (1988). Metabolizm glutationu i jego selektywna modyfikacja. The Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, a., & Anderson, m. I. (1983). Glutation. Ann. Rev Biochem., 52, 711-760.
- Morris, zm., War, c., Khurasany, m., Guilford, f., & Saviola, b. (2013). Glutathiona Funkcje makrofagów w HIV. Journal of Interferon & Cytokine Research, jedenaście.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Nelson, zm. L., & Cox, m. M. (2009). Zasady biochemii lehninger. Omega Editions (Ed.). https: // doi.Org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chaouch, s., Han i. Siema., Neukermans, j., Marquez-Garcia, ur.,... foyer, c. H. (2012). Glutation w roślinach: zintegrowany przegląd. Roślina, komórka i środowisko, 35, 454-484.
- Pizzorno, J. (2014). Glutation! Medycyna śledcza, 13(1), 8-12.
- Qanungo, s., Starke, d. W., Pai, h. V, myyal, j. J., & Nieminen, do. (2007). Glutation. The Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, str. R., & Ji, l. L. (2001). Suplementacja i trening Glutathiona zwiększa opór mięśnia sercowego wobec niedokrwienia-reperfuzji in vivo. Ann. J. Physiol. Cyrk serca. Physiol., 281, 679-688.
- Sies, h. (2000). Glutation i jego rola w funkcjach komórkowych. Biologia wolna radykalna i medycyna r, 27(99), 916-921.
- Wu, g., Kły i., Yang, s., Lupton, J. R., & Turner, n. D. (2004). Metabolizm glutationu i jego implikacje dla zdrowia. American Society for Nutritional Sciences, 489-492.
- « Równomiernie przyspieszone charakterystyka ruchu prostoliniowego, wzory
- Charakterystyka, typy, funkcje »

