Charakterystyka, typy, funkcje
- 3523
- 470
- Matylda Duda
Kines albo kinazySą to białka o aktywności enzymatycznej, które są odpowiedzialne za katalizowanie przenoszenia grup fosforanowych (PO4-3) do różnych rodzajów cząsteczek. Są to niezwykle powszechne enzymy w naturze, w których wykonują funkcje transcendentalne dla żywych organizmów: uczestniczą metabolizm, oznakowanie, a także w komunikacji komórkowej.
Dzięki dużej liczbie procesów, w których wykonują wiele funkcji, kinazy są jednym z najczęściej badanych rodzajów białka, nie tylko na poziomie biochemicznym, ale także na poziomie strukturalnym, genetycznym i komórkowym.
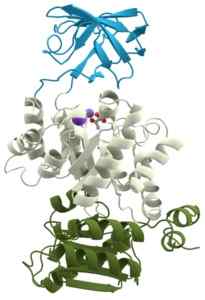
 Domeny struktury enzymu kinazy pirurupato (PYK) enzym glikolityczny (źródło: Thomas Splettssser (www.Scistyle.com) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Domeny struktury enzymu kinazy pirurupato (PYK) enzym glikolityczny (źródło: Thomas Splettssser (www.Scistyle.com) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Ustalono, że ludzki genom ma co najmniej 500 genów, które kodują enzymy należące do grupy kinaz, których „akceptory” grup fosforanowych mogą być węglowodany, lipidy, nukleozydy, białka i inne typy cząsteczek organicznych.
Te enzymy są klasyfikowane w grupie fosfotransferaz (EC 2.7) i zwykle stosują się jako cząsteczki „dawcy” fosforanu do związków o wysokiej energii, takich jak ATP, GTP, CTP i inne.
[TOC]
Charakterystyka
Termin „kinaza”, jak wspomniano, zwykle odnosi się do wszystkich enzymów odpowiedzialnych za przeniesienie grupy fosforanowej ATP w kierunku innej cząsteczki odbioru lub „akceptowania” grupy fosforanowej grupy fosforanowej.
Chociaż enzymy te zasadniczo katalizują tę samą reakcję przenoszenia grup fosforylowych, istnieje wielka różnorodność, nie tylko w odniesieniu do struktury, ale także swoistości podłoża i tras komórkowych, w których uczestniczą.
Zasadniczo jego struktura składa się z arkuszy β-Peelowanych i śmigieł α, które są specyficznie złożone w celu utworzenia miejsca aktywnego, i wspomniane miejsce aktywne zwykle zawiera dodatnio obciążone jony (kationów), które stabilizują ujemne obciążenia grup fosforanowych, które przenoszą.
Na aktywnym lub blisko tego znajdują się dwa miejsca skrzyżowa.
Ogólną reakcję tych enzymów (fosforylacja) można rozważyć w następujący sposób:
Substrat ATP + → Fosforylowany substrat ADP +
Gdzie ATP przekazuje grupę fosforanową, która wygrywa substrat.
Chłopaki
Zgodnie z klasyfikacją Komitetu Nomenklatury Międzynarodowej Związku Biochemii i Biologii Molekularnej (NC-IBMB) kinazy znajdują się w grupie fosfotransferaz (WE. 2.7, enzymy, które przenoszą grupy zawierające fosfor), które z kolei są podzielone w około 14 klasach (EC 2.7.1 - EC 2.7.14).
Może ci służyć: heterosis: poprawa zwierząt, roślin, istoty ludzkiejPodstawowe różnice między tymi 14 rodzajami fosfotransferaz są związane z chemiczną naturą cząsteczki „akceptora” grupy fosforanowej, którą przenoszą (lub z naturą części cząsteczki, którą otrzymuje grupa fosforanowa).
W ramach tej kategorii (enzymy fosfotransferazy) istnieją również enzymy, które przenoszą fosforany, ale nie wykorzystują cząsteczek ATP, takich jak „dawca”, ale stosują fosforany nieorganiczne.
Ogólnie rzecz biorąc, klasy te są opisane w następujący sposób:
EC 2.7.1: Enzymy fosfotransferazy, które mają akceptor grupy fosforanowej alkohol
Jest to jedna z najważniejszych grup metabolizmu energetycznego wielu organizmów, ponieważ zawiera enzymy odpowiedzialne za fosforylację węglowodanów i ich pochodne, takie jak glukoza, galaktoza, fruktoza, mannosa, glikosamina, ryboza i ryboza, ksyloza, glikcerolololowa , Pirogronian, mevalonato, arabinosa, inozytol,.
Przykładem tych wspólnych enzymów są heksochinaza, glikochinaza, fosfofrucerachinaza i kinaza piruruwiato, które są bezpośrednio zaangażowane w trasę glikolityczną odpowiedzialną za utlenianie glukozy do wytwarzania energii w postaci ATP.
EC 2.7.2: Enzymy fosfotransferazy, które mają grupę karboksylową jako akceptor fosforanu
W ramach tego rodzaju enzymów flinazy lub fosfotransferazy są enzymy, które przenoszą grupy fosforanowe do części cząsteczek z grupami karboksylowymi, takimi jak octan, karbaminian, asparagan, fosfoglikinian, między innymi.
EC 2.7.3: enzymy fosfotransferazy, które mają atom azotowy jako akceptor fosforanu
Metabolicznie, ta grupa enzymów ma również ogromne znaczenie, ponieważ są one odpowiedzialne za przenoszenie grup fosforanowych do cząsteczek, takich jak kreatynina, arginina, glutamina, guanidyna-akcja itp.
EC 2.7.4: Enzymy fosfotransferazy, które mają jako akceptor grupy fosforanowej kolejna grupa fosforanowa
Znaczna część enzymów tej grupy pracuje w regulacji tworzenia lub hydrolizy związków o wysokiej energii, takich jak ATP, GTP, CTP i inne, ponieważ są one odpowiedzialne za dodanie, usuwanie lub wymianę grup fosforanowych między tego rodzaju cząsteczkami lub jego prekursory.
Uczestniczą również w przenoszeniu grup fosforanowych na inne wcześniej fosforylowane cząsteczki, które mogą mieć charakter lipidowy, węglowodany lub pochodzące z nich.
Przykładem tych ważnych enzymów są kinaza adenylan, kinaza fosforanowa nukleozydowa, kinaza adenylanowa Tryposforan nukleozydowa, kinaza UMP/CMP i kinaza fosforanu farnezylu itp.
EC 2.7.6: Enzymy diposfotransferazy
Diposfotransferazy katalizują przenoszenie dwóch grup fosforanów jednocześnie w kierunku tego samego podłoża. Przykładem tych enzymów są defosfochinaza rybozy-fosforanowa, defosfochinaza tiamina i defosfochinaza GTP, która jest ważnym enzymem w metabolizmie purynów.
Może ci służyć: Sphingomyeline: co to jest, struktura, funkcje, syntezaEC 2.7.7: Specyficzne enzymy fosfotransferansferazy nukleotydów (nukleotydy fosfotransferazy)
Nurydos fosfotransferazy uczestniczą w wielu procesach komórkowych zaangażowanych w aktywację i inaktywację innych białek i enzymów, a także w niektórych mechanizmach naprawy DNA.
Jego funkcją jest przenoszenie nukleotydów, zwykle nukleotydów monofosforanowych różnych zasad azotu. W tego rodzaju enzymach znajdują się polimerazy DNA i RNA (zarówno DNA, jak i zależne RNA), UDP-glukosa 1-fosforanowa urydiltransferaza, między innymi.
EC 2.7.8: Enzymy przenoszące grupy fosforanu za pomocą podstawień
Ta klasa ma znaczące funkcje w trasach metabolizmu lipidów, szczególnie w jej syntezy. Są odpowiedzialne za przeniesienie fosforylowanych cząsteczek (fosforany z podstawieniami) w stronę innych cząsteczek „akceptora”.
Przykładem tej grupy enzymów są fosfotransferaza etanoloamina, diacyloglicerol colina fosfotransferaza, syntaza sfingomii itp.
EC 2.7.9: Enzymy fosfotransferazy z sparowanymi akceptorami
Te enzymy wykorzystują pojedynczy dawcę grupy fosforanowej (ATP lub pokrewne) do fosforylowania dwóch różnych cząsteczek akceptora. Pyrogronian fosforanu (PPDK) i fosfoglucano dicynaza są przykładami tych enzymów.
Fosfotransferazy, które fosforylują reszty aminokwasowe różnych rodzajów białek
EC 2.7.10: kinazy białkowe-lirozyny
Kinazy białko-pirozynowe są enzymami, które katalizują przenoszenie grup fosforanowych specyficznie do reszt tyrozynowych w łańcuchach polipeptydowych różnych rodzajów akceptorów białka.
EC 2.7.11: kinazy białkowe-serynowe/treoniny
Podobnie jak kinazy białko-pirozynowe, ta grupa enzymów katalizuje przenoszenie grup fosforanowych do odpadów seryny lub treminy w innych białkach.
Znanym przykładem tych białek jest rodzina białek kinazy C, które uczestniczą na wiele sposobów, ale szczególnie w metabolizmie lipidów.
Ta grupa obejmuje również wiele cyklicznych białek zależnych od AMP i cykliczny GMP, z ważnymi implikacjami w różnicowaniu komórkowym, wzrostowi i komunikacji.
EC 2.7.12: Kinazy to podwójna swoistość (która może działać zarówno w odpadach seryny/treminy, jak i tyrozynowej)
Białka kinazy aktywowane mitogenem (MAPKK) są częścią tej grupy enzymów, które są zdolne do niewyraźnego odpadu, treminy lub tyrozynowych innych białek kinazy.
Histydyna mutkish (EC 2.7.13) i kinazy białkowe-argininy (EC 2.7.14)
Istnieją inne białka kinazy zdolne do przenoszenia grup fosforanowych do reszt histydyny i argininy w niektórych rodzajach białek i są to białka kinazowe i kinazy białkowe-argininy.
Inne formy klasyfikacji
Według różnych autorów kinazy można lepiej zaklasyfikować zgodnie z rodzajem podłoża, które stosują jako akceptor grupy fosforanowej.
Może ci służyć: nukleozyd: Charakterystyka, struktura i zastosowaniaInni uważają, że najlepszym sposobem klasyfikacji tych enzymów jest struktura i cechy ich aktywnego miejsca, to znaczy, zgodnie z konformacją i obecnością jonów lub niektórych cząsteczek w tym samym.
Zgodnie z typem substratu kinazy można klasyfikować jako białko kinowe (które fosforylują inne białka), kinazy LipA (które fosforylują lipidy), kinazy węglowodanów (które fosforylują różne typy węglowodanów), nukleozyd fosforylae (nukleozyd fosforyliny), itp.
Funkcje
Enzymy grupy kinazy mają wszechobecny charakter, a pojedyncza komórka może pomieścić setki różnych rodzajów, katalizując reakcje na wielu trasach komórkowych.
Jego funkcje mogą być bardzo zróżnicowane:
-Uczestniczą w wielu procesach sygnalizacji i komunikacji komórkowej, zwłaszcza białek kinazy, które katalizują kolejną fosforylację innych białek kinazy (wodospady fosforylacji) w odpowiedzi na bodźce wewnętrzne i zewnętrzne.
-Niektóre z tych białek z aktywnością enzymatyczną mają centralne funkcje metabolizmu węglowodanów, lipidów, nukleotydów, witamin, kofaktorów i aminokwasów. Na przykład nic więcej w glikolizy nie uczestniczy co najmniej 4 kinazy: heksochinaza, fosfofrucerachinaza, kinaza fosfoglikinianu i kinaza pirogronianowa.
-Wśród funkcji sygnalizacyjnych kinazy biorą udział w procesach regulacji ekspresji genetycznej, skurczu mięśni i oporności na antybiotyki w różnych rodzajach organizmów żywych.
-Białka puttera-kanalia mają funkcje w regulacji wielu dróg transdukcji sygnału, które są związane z rozwojem i komunikacją w wielokomórkowych metazosach.
-Modyfikacja białek fosforylacji (w innych kontekstach komórkowych innych niż sygnalizacja komórkowa) jest ważnym elementem regulacji aktywności dużych ilości enzymów, które uczestniczą w różnych procesach metabolicznych. Taki jest przykład regulacji cyklu komórkowego przez wiele białek zależnych od kinazy.
-Kinazy fosforarne lipidowe są niezbędne do przebudowy procesów błon komórkowych, a także syntezy i tworzenia nowych błon.
Bibliografia
- Cheek, s., Zhang, h., & Grishin, n. V. (2002). Klasyfikacja sekwencji i struktury kinaz. Journal of Molecular Biology, 2836(02), 855-881.
- Cooper, J. (2018). Britannica Encyclopaedia. Pobrano z Britannica.com
- Da Silva, G. (2012). Postęp w kinaz białkowych. Rijaka, Chorwacja: Intech Open.
- Krebs, e. (1983). Historyczne perspektywy fosforylacji białek i system klasyfikacji kinaz białkowych. Phil. Trans. R. Soc. Lond. B, 302, 3-11.
- Krebs, e. (1985). Fosforylacja białek: główny mechanizm regulacji biologicznej. Transakcje społeczeństwa biochemicznego, 13, 813-820.
- Komitet Nomenklatury Międzynarodowej Związku Biochemii i Biologii Molekularnej (NC-IBMB). (2019). Pobrano z QMUL.AC.Wielka Brytania
- « Charakterystyka glutationu, struktura, funkcje, biosynteza
- Jednolite charakterystyka ruchu prostoliniowego, formuły, ćwiczenia »

