Charakterystyka glukozy oksydazy, struktura, funkcje
- 3040
- 538
- Prokul Woliński
glukoza oksydazy, Znany również jako β-D-glikoza: tlen-1-oksydoraduktaza, glukoza-1-oksydaza lub po prostu glukoza oksydazy, jest enzymem oksydoregredytazy obowiązywania utleniania β-D-glikozy, która wytwarza d-glukonolakton i wodorowe nadtlenki.
Zostało to odkryte pod koniec lat dwudziestych XX wieku w fragmentach grzybów Aspergillus Niger. Jego obecność została udowodniona w grzybach i owadach, w których trwałe wytwarzanie nadtlenku wodoru, przez jego działanie katalityczne, pełni ważne funkcje w obronie przed patogennymi grzybami i bakteriami.
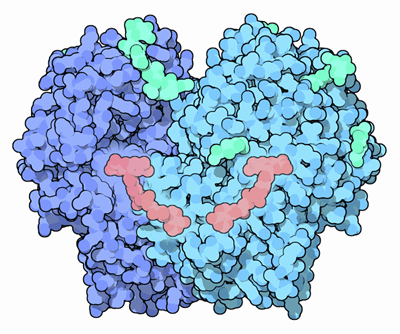
 Schemat struktury enzymu glukozy oksydazy (źródło Arcadian, Via Wikimedia Commons)
Schemat struktury enzymu glukozy oksydazy (źródło Arcadian, Via Wikimedia Commons) Obecnie glukoza oksydazy została oczyszczona z wielu różnych źródeł grzybów, szczególnie z gatunków Aspergillus I Penicillium. Chociaż może używać innych substratów, jest dość selektywny w celu utleniania β-D-glikozy.
Ma wiele zysków w kontekstach przemysłowych i komercyjnych, co jest spowodowane niskim kosztem produkcji i dużej stabilności.
W tym sensie enzym ten jest stosowany zarówno w branży produkcji żywności, jak i w kosmetologii, w diagnozie farmaceuty i klinicznej, nie tylko jako addytywny, ale jako bioczujnik i/lub odczynnik analityczny różnych roztworów i płynów ustrojowych.
[TOC]
Charakterystyka
Glukoza oksydazy jest kulistą flawoproteiną, która wykorzystuje tlen cząsteczkowy jako akceptor elektronów do wytwarzania, z glukozy, D-glicon-laktonu i nadtlenku wodoru.
W układzie komórkowym wytwarzanym nadtlenkiem wodoru może być spożywane przez enzym katlasowy w celu wytworzenia tlenu i wody. Z kolei w niektórych organizmach d-glukonolakton jest hydrolizowany do kwasu glukonowego, który może wykonywać różne funkcje.
Opisane do tej pory enzymy glukozy oksydazy są w stanie utleniać monosacharydy i inne rodzaje związków, i jak wcześniej skomentowano, są one dość specyficzne dla anomeru β D-glikozy.
Może ci służyć: rozmaz krwi: cechy, typy, techniki i histologiaPracują w kwasowych zakresach pH, od 3.5 do 6.5 i, w zależności od mikroorganizmu, zakres ten może się znacznie różnić. Ponadto glukoza oksydazy grzybowej jest jednym z trzech rodzajów białek, które są przyłączone do ortofosforanów.
Podobnie jak inne katalizatory biologiczne, enzymy te mogą być hamowane przez różne cząsteczki, w tym srebro, miedź i rtęć, hydrazyna i hydroksyloamina, fenylohydrazyna, bisulfini sodu, między innymi,.
Struktura
Glukoza oksydazy jest dimickim białkiem o dwóch identycznych monomerach 80 kDa, kodowanych przez ten sam gen, kowalencyjnie zjednoczony przez dwa mosty disulfurowe i którego dynamizm jest zaangażowany w katalityczny mechanizm enzymu.
W zależności od ciała średnia masa cząsteczkowa homodimeru.
Struktura monomeru
Analiza monomerów różnych glukozy oksydazy występującej w naturze ujawnia, że są one podzielone na dwa różne regiony lub domeny: jeden, który wiąże się z modą, a drugą, która wiąże się z glukozą.
Domena Unii FAD składa się z arkuszy β, podczas gdy złącze glukozy maste.
Glikozylacja
Pierwsze badania przeprowadzone z enzymu DO. Niger Ustalają, że to białko ma 20% jego świeżej masy złożonej z aminoazúces i że kolejne 16-19% odpowiada węglowodanom, z czego ponad 80% jest ręcznie wiatrowym odpadem z białkiem przez linki przez linki do linków N- Lub ALBO-glikozydowy.
Chociaż te węglowodany nie są niezbędne do katalizy, istnieją doniesienia, które wskazują, że eliminacja lub usunięcie tych słodkich odpadów zmniejsza stabilność strukturalną białka. Może to wynikać z rozpuszczalności i odporności na proteazy, które daje mu warstwa węglowodanów.
Może ci służyć: zwierzęta kręgowcaFunkcje
W grzybach i owadach, jak omówiono, glukoza oksydazy wypełnia istotną funkcję obrony przed patogennymi grzybami i bakteriami poprzez utrzymanie stałego źródła stresu oksydacyjnego przez trwałe wytwarzanie nadtlenku wodoru.
Mówienie o innych ogólnych funkcjach enzymu glukozy oksydazy nie jest tak proste, ponieważ ma bardzo szczególne zyski w różnych organizmach, które to wyrażają. Na przykład w pszczołach wydzielanie gruczołów podskórnych w kierunku śliny przyczynia się do zachowania miodu.
U innych owadów, w zależności od stadionu cyklu życia, działa w dezynfekcji żywności połkniętej i tłumienia systemów obrony roślin (na przykład w przypadku owadów fitofagicznych)).
Dla wielu grzybów jest to kluczowy enzym dla tworzenia nadtlenku wodoru, który promuje degradację ligniny. Z kolei dla innego rodzaju grzybów jest to jedynie system obrony przeciwbakteryjnej i przeciwgrzybiczej.
Funkcje w branży
W dziedzinie przemysłowej glukoza oksydazy została wykorzystana na wiele sposobów, wśród których można określić:
- Jako dodatek podczas przetwarzania żywności, gdzie działa jako przeciwutleniacz, konserwujący i stabilizator produktów spożywczych.
- W zachowaniu pochodnych nabiału, gdzie pracuje jako środek przeciwdrobnoustrojowy.
- Jest stosowany podczas produkcji pyłu jajowego do eliminacji glukozy i produkcji nadtlenku wodoru, który zapobiega wzrostowi mikroorganizmów.
- Ma również użyteczność w produkcji niskich win alkoholu. Wynika to z jego zdolności do konsumpcji glukozy obecnej w sokach używanych do fermentacji.
Może ci służyć: laktoferryna: struktura i funkcje- Kwas glukonowy, jeden z wtórnych produktów reakcji katalizowanej przez glukozę oksydazy, jest również wykorzystywany do barwienia tekstylnego, czyszczenia powierzchni metali, jako dodatek do żywności, jako dodatek w detergentach, a nawet w lekach i kosmetykach.
Czujniki glukozy
Istnieje kilka testów cenzurowania stężenia glukozy w różnych warunkach opartych na unieruchomieniu enzymu glukozy oksydazy w danym wsparciu.
W branży zaprojektowano trzy typy prób, które wykorzystują ten enzym jako bioczujnik, a różnice między nimi dotyczą systemu wykrywania zużycia glukozy i/lub tlenu lub produkcji nadtlenku wodoru.
Oprócz przydatności w przemyśle spożywczym, bioczujniki glukozy są wykorzystywane do oznaczania ilości glukozy w płynach ustrojowych, takich jak krew i mocz. Są to zwykle rutynowe badania dotyczące wykrywania warunków patologicznych i innych warunków fizjologicznych.
Bibliografia
- Bankar, s. B., Bule, m. V, Singhal, R. S., & Ananthanarayan, L. (2009). Oksydaza glukozy - przegląd. Postępy biotechnologiczne, 27(4), 489-501.
- Haouz, a., Twist, c., Zentz, c., Tauc, str., & Alpert, b. (1998). Właściwości dynamiczne i strukturalne enzymu oksydazy glukozowej. EUR BIOPHYS, 27, 19-25.
- Raba, J., & Mottola, H. DO. (1995). Oksydaza glukozy jako odczynnik analityczny. Krytyczne recenzje w chemii analitycznej, 25(1), 1-42.
- Wilson, r., & Turner, do. (1992). Oksydaza glukozy: idealny enzym. BioSensors & Bioelektronika, 7, 165-185.
- Wong, c. M., Wong, k. H., & Chen, x. D. (2008). Oksydaza glukozy: naturalne występowanie, funkcja, właściwości i zastosowania przemysłowe. Biotechnol Microbiol Appl, 75, 927-938.

