Londyńskie siły
- 4827
- 1434
- Marianna Czarnecki
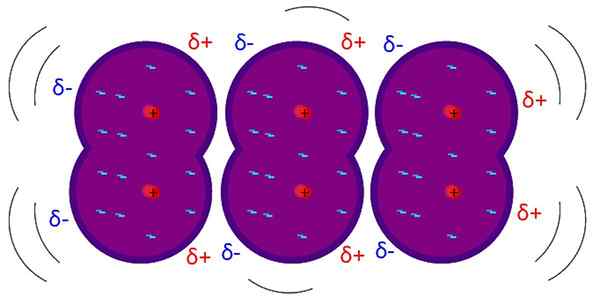
 Siły londyńskie są mięśniowymi słabymi interakcjami. Źródło: Riccardo Rovinetti, Wikimedia Commons
Siły londyńskie są mięśniowymi słabymi interakcjami. Źródło: Riccardo Rovinetti, Wikimedia Commons Jakie są siły londyńskie?
Londyńskie siły, Londyńskie siły dyspersji lub interakcje indukowane-dipolowe są najsłabszym rodzajem interakcji międzycząsteczkowych. Jego imię jest spowodowane wkładem fizyka teoretycznego Fritz London (1900–1954) i jego badań w dziedzinie fizyki kwantowej.
Siły londyńskie wyjaśniają, w jaki sposób cząsteczki oddziałują, których struktury i atomy tworzą tworzenie stałego dipolu; to znaczy zasadniczo dotyczy cząsteczek lub atomów izolowanych z gazów szlachetnych.
W przeciwieństwie do innych sił Van der Waalsa, wymaga to wyjątkowo krótkich odległości.
Charakterystyka sił londyńskich
 Dystrybucja jednorodnych opłat. Źródło: Gabriel Bolívar
Dystrybucja jednorodnych opłat. Źródło: Gabriel Bolívar Jakie cechy powinny mieć cząsteczka, aby mogła wchodzić w interakcje za pośrednictwem sił londyńskich? Odpowiedź jest taka, że każdy mógłby to zrobić, ale gdy istnieje stały moment dipolowy, dominują interakcje typu dipol-dipolo, a nie dyspersja, bardzo niewiele przyczyniając się do fizycznej natury substancji.
W strukturach, w których nie ma bardzo bardzo elektroonywagatywnych atomów lub których rozkład obciążenia elektrostatycznego jest jednorodny, nie ma końca ani regionu, który można uznać za bogaty (δ-) lub słabe (δ+) w elektronach.
W takich przypadkach inne rodzaje sił muszą interweniować, a poza tym związki te mogą istnieć tylko w fazie gazowej, niezależnie od działających na nich warunków ciśnienia lub temperatury.
Jednorodny rozkład obciążenia
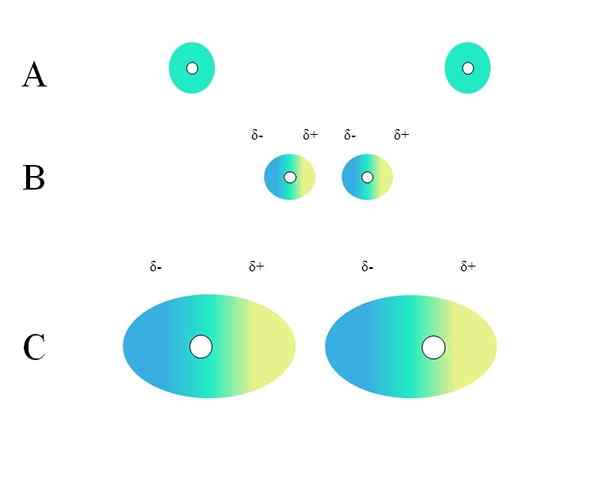
Dwa izolowane atomy, takie jak neon lub argon, mają jednorodny rozkład obciążenia. Można to zobaczyć w doskonałym obrazie. Białe koła w środku reprezentują jądra, dla atomów lub szkieletu molekularnego, dla cząsteczek. Ten rozkład obciążenia można uznać za chmurę zielonych elektronów.
Dlaczego szlachetne gazy spotykają się z tą jednorodnością? Ponieważ mają całkowitą warstwę elektroniczną, więc ich elektrony teoretycznie muszą poczuć równie przyciąganie obciążenia jądra we wszystkich orbitalach.
Z drugiej strony, w przypadku innych gazów, takich jak tlen atomowy (O), jego warstwa jest niekompletna (co jest obserwowane w konfiguracji elektronicznej) i zmusza ją do utworzenia cząsteczki dwuatomicznej lub2 Aby zrekompensować ten niedobór.
Zielone kółki mogą być również cząsteczkami, małymi lub dużymi. Jego elektrony orbity chmurują wszystkie atomy, które to wymyślą, szczególnie o najbardziej elektrowni. Wokół tych atomów chmura się skoncentruje się i będzie bardziej ujemna, podczas gdy inne atomy będą miały niedobór elektroniczny.
Może ci służyć: nie -spolarne kowalencyjne wiązanieJednak ta chmura nie jest statyczna, ale dynamiczna, więc w pewnym momencie powstanie krótkie regiony δ i δ+, a wystąpi zjawisko nazywane Polaryzacja.
Polaryzowalność
W zielonej chmurze wskazuje jednorodny rozkład obciążenia ujemnego. Jednak dodatnia siła przyciągania wywierana przez jądro może wahać się na elektronach. Powoduje to deformacja chmury, tworząc w ten sposób regiony δ, niebieskie i δ+, żółty.
Ten nagłe moment dipolowy w atomie lub cząsteczce może zniekształcać sąsiednią chmurę elektroniczną; Innymi słowy, indukuje nagły dipol nad sąsiadem (B, Superior Image).
Wynika to z faktu, że region Δprzepustowy zakłóca sąsiednią chmurę, jej elektrony odczuwają odpychanie elektrostatyczne i są zorientowane na przeciwnym biegunie, wyglądając na δ+.
Zwróć uwagę, jak pozytywne słupy są wyrównane z negatywami, podobnie jak cząsteczki z trwałymi momentami dipolowymi. Im bardziej obszerna chmura elektroniczna, tym większe trudności w jądrze utrzyma go jednorodne w przestrzeni; A ponadto będzie to jego deformacja, jak można zobaczyć w C.
Dlatego małe atomy i cząsteczki są bardziej mało prawdopodobne spolaryzowane przez jakąkolwiek cząsteczką otoczenia. Przykładem tej sytuacji ilustruje mała cząsteczka wodoru, H2.
Aby skondensować, a nawet więcej, krystalizować, potrzebuje wygórowanych ciśnień, aby zmusić swoje cząsteczki do fizycznej interakcji.
Jest odwrotnie proporcjonalny do odległości
Chociaż powstają natychmiastowe dipole, które wywołują wokół nich innych, nie są wystarczające, aby utrzymać atomy lub cząsteczki razem.
W B jest odległość D który oddziela dwie chmury i ich dwa jądra. Tak aby oba dipole mogą pozostać na pewien czas, odległość tej D Musi być bardzo mały.
Ten warunek musi zostać spełniony, niezbędna cecha sił Londynu (pamiętaj o zamknięciu rzepu), tak że dostarczono notoryczny wpływ na fizyczne właściwości materii.
Raz D Bądź mały, rdzeń lewicy w B zacznie przyciągać niebieski region δ- sąsiedniego atomu lub cząsteczki. To dodatkowo zdeformuje chmurę, jak widać w C (jądro nie jest już w środku, ale po prawej).
Może ci służyć: alkenyPotem jest punkt, w którym oba chmury dotykają i „odbijają się”, ale do powolności na tyle, aby mieć je razem z czasem.
Dlatego siły londyńskie są odwrotnie proporcjonalne do odległości D. W rzeczywistości współczynnik jest równy D7, Zatem minimalna zmienność odległości między zarówno atomami lub cząsteczkami osłabia lub wzmocni dyspersję Londynu.
Jest bezpośrednio proporcjonalny do masy cząsteczkowej
Jak zwiększyć rozmiar chmur, aby były łatwiejsze do spolaryzowania? Dodając elektrony, a w tym celu jądro musi mieć więcej protonów i neutronów, zwiększając w ten sposób masę atomową; lub dodanie atomów do szkieletu cząsteczki, która z kolei zwiększyłaby jej masę cząsteczkową.
W ten sposób jądra lub szkielet molekularny rzadziej utrzymywałby chmurę elektroniczną przez cały czas. Dlatego im większe zielone kręgi rozważane w A, B i C, tym bardziej będą polaryzowani i większe będą również ich interakcje sił Londynu.
Ten efekt jest wyraźnie obserwowany między B i C, a może być jeszcze bardziej, gdyby kółka miały większą średnicę. To rozumowanie jest kluczem do wyjaśnienia właściwości fizycznych wielu związków w zależności od ich mas molekularnych.
Przykłady sił londyńskich
 Naturalny przykład sił londyńskich: nogi gecos
Naturalny przykład sił londyńskich: nogi gecos W naturze
W życiu codziennym istnieją niezliczone przykłady londyńskich sił dyspersji bez potrzeby zapuszczania, w pierwszej kolejności, mikroskopijnego świata.
Jeden z najczęstszych i najczęstszych przykładów znajduje się w nogach gadów znanych jako GECO (obraz doskonały) i w wielu owadach (także w Spiderman).
W nogach mają kilka podkładek, z których wyróżniają się tysiące małych włókien. Na zdjęciu widać GECO pozującego na zboczu skały. Aby to osiągnąć, wykorzystuje siły międzycząsteczkowe między skałą a włóknami ich nóg.
Każdy z tych włókien słabo oddziałuje z powierzchnią, na której mały gad. GECO są również w stanie wspinać się na gładkie i idealne powierzchnie, takie jak kryształy.
Może ci podawać: azotyn potasu (KNO2): struktura, właściwości i zastosowaniaZamyka
Alkan są nasyconymi węglowodorami, które również oddziałują przez siły londyńskie. Jego struktury molekularne po prostu składają się z węgli i hydrogenów zjednoczonych przez proste wiązania. Ponieważ różnica w elektroonywościach między C i H jest bardzo mała, są to związki apolarne.
Zatem metan, cho4, Najmniejszy węglowodor ze wszystkich, gotuje się w temperaturze -161.7. c. Ponieważ C i H są dodawane do szkieletu, inne alkan są uzyskiwane przy wyższych masach cząsteczkowych.
W ten sposób powstaje etan (-88.6. c), butan (-0.5. c) i oktan (125.7. c). Zwróć uwagę, w jaki sposób ich punkty wrzenia rosną, gdy alkan stają się cięższe.
Wynika to z faktu, że ich chmury elektroniczne są bardziej polaryzowalne, a ich struktury mają większy powierzchnia, który zwiększa kontakt między ich cząsteczkami.
Oktan, chociaż jest to związek apolowy, ma temperaturę wrzenia większą niż w przypadku wody.
Halogeny i gazy
Siły w Londynie są również obecne w wielu gazowych substancjach. Na przykład n cząsteczki2, H2, WSPÓŁ2, F2, Cl2 I wszystkie szlachetne gazy oddziałują przez te siły, ponieważ mają jednorodną rozkład elektrostatyczny, który może ponieść migawkę i powodować polaryzacje.
Gazy szlachetne to He (hel), neon (neon), AR (Argon), KR (Kripton), XE (Xenon) i RN (radon). Od lewej do prawej ich temperatury wrzenia rosną wraz ze wzrostem mas atomowych: -269, -246, -186, -152, -108 i -62 ºC.
Halogeny również oddziałują przez te siły. Fluor to gaz w temperaturze pokojowej, podobnie jak chlor. Brom o większej masie atomowej jest w normalnych warunkach, jak czerwonawy ciecz, i jod, do końca, tworzy fioletową substancję stałą, która szybko sublimuje, ponieważ jest cięższa niż inne halogeny.
Bibliografia
- Whitten, Davis, Peck i Stanley. Chemia. (8 wyd.). Cengage Learning, s. 452-455.
- Angeles Méndez. (22 maja 2012 r.). Siły dyspersji (z Londynu). Odzyskane z: chemii.Laguia2000.com
- Londyńskie siły dyspersji. Odzyskane z: chem.Purdue.Edu
- Helmestine, Anne Marie, pH.D. (22 czerwca 2018 r.). 3 rodzaje sił międzycząsteczkowych. Odzyskane z: Thoughtco.com
- Ryan Ilagan i Gary L Bertrand. Interakcje z dyspersją w Londynie. Zaczerpnięte z: chem.Librettexts.org
- Chempage Norials. Londyńskie siły. Odzyskane z: chem.Wisc.Edu
- Kamereon. (22 maja 2013 r.). Salamanqueas: geco i siły van der Waalsa. Odzyskane z: almabiologica.com

