Hydracy
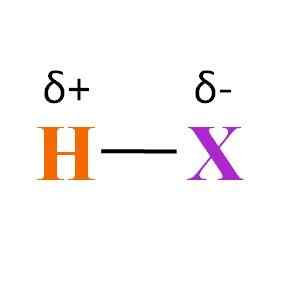
- 1249
- 330
- Herbert Wróblewski
Co to są hydrace?
Hydracy, o Kwasy binarne, są związkami rozpuszczonymi w wodzie, które składają się z wodoru i elementu niemetalicznego: halogenki wodorowe. Jego ogólny wzór chemiczny można wyrazić jako HX, gdzie H jest atomem wodoru, a X elementem niemetalicznym.
X może należeć do grupy 17, halogenów lub do elementów grupy 16 bez włączenia tlenu. W przeciwieństwie do okacidów, hydracids nie mają tlenu. Ponieważ hydraceidy są związkami kowalencyjnymi lub molekularnymi, należy wziąć pod uwagę łącze H-X. Ma to ogromne znaczenie i określa cechy każdej hydracy.
Link H-X
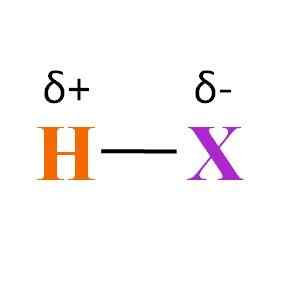 Ogólna wzór chemiczny hydracy. Źródło: Gabriel Bolívar
Ogólna wzór chemiczny hydracy. Źródło: Gabriel Bolívar Co można powiedzieć o linku H-X? Jak widać na obrazie wyższym, istnieje stały iloczyn momentu dipolowego różnych elektroengatyczności między H i x. Ponieważ x jest zwykle bardziej elektroongenacyjne niż H, przyciąga chmurę elektroniczną i kończy się ujemnym obciążeniem częściowym δ-.
Zamiast tego, podając część swojej gęstości elektronicznej na x, kończy się dodatnim obciążeniem częściowym δ+. Im bardziej ujemny δ-, tym najbogatsze w elektronach będzie x i tym większy elektroniczny niedobór H H. Dlatego, w zależności od elementu x, hydrocencja może być mniej więcej polarna.
Obraz pokazuje również strukturę hydracidów. H-X jest cząsteczką liniową, która może oddziaływać z inną według jednego z jej końca. Im bardziej polarny jest HX, jego cząsteczki będą oddziaływać z większą siłą lub powinowactwem. W rezultacie wzrosną jego punkty gotowania lub fuzji.
Jednak interakcje H-X-H-X pozostają wystarczająco słabe, aby spowodować stały hydrace. Dlatego w warunkach ciśnienia i temperatury otoczenia są substancje gazowe; z wyjątkiem HF, który odparowuje powyżej 20ºC.
Ponieważ? Ponieważ HF jest w stanie utworzyć silne mosty wodorowe. Podczas gdy inne hydraceidy, których elementy nie -metaliczne są mniej elektroonegatywne, ledwo mogą znajdować się w fazie ciekłej poniżej 0º C. Na przykład HCl gotuj w przybliżeniu w temperaturze -85º C.
To hydraceful kwasowe substancje? Odpowiedź dotyczy dodatniego obciążenia częściowego δ+ na atomu wodoru. Jeśli δ+ jest bardzo duże lub bardzo słabe wiązanie H-X, Hx będzie silnym kwasem, podobnie jak w przypadku wszystkich hydraceenów halogenowych, gdy ich odpowiednie halogenki zostaną rozpuszczone w wodzie.
Charakterystyka hydrace
Fizyczny
Przezroczyste rozwiązania
Widocznie wszystkie hydracidy są przezroczystymi roztworami, ponieważ HX są bardzo rozpuszczalne w wodzie. Mogą mieć żółtawe tony zgodnie z rozpuszczonymi stężeniami HX.
Pali
Oznacza to, że wygłaszają gęste, żrące i irytujące opary (niektóre z nich są nawet nudnościami). Wynika to z faktu, że cząsteczki HX są bardzo lotne i oddziałują z pematą wodną otaczającą roztwory. Ponadto Hx w ich bezwodnych postaciach są związkami gazowymi.
Są przewodnikami energii elektrycznej
Hydracy to dobre przewody energii elektrycznej. Chociaż Hx są gatunkami gazowymi do warunków atmosferycznych, kiedy rozpuszczają się w wodzie, uwalniają jony (h+X-), które umożliwiają przejście prądu elektrycznego.
Może ci służyć: procesy termodynamiczneJego temperatury wrzenia są wyższe niż w ich bezwodnych postaci
To znaczy, HX (AC), który oznacza hydrację, wrzenia w temperaturach wyższych niż Hx (g). Na przykład chlorek wodoru, HCl (G), gotuje się w -85º C, ale kwas hydrachlorowy, jego hydracja, około 48º C.
Ponieważ? Ponieważ cząsteczki gazowe HX są otoczone wodą. Wśród nich mogą wystąpić dwa rodzaje interakcji: mosty HX - H2Lub - hx lub solowanie jonów, h, h3ALBO+(AC) i x-(AC). Fakt ten jest bezpośrednio związany z cechami chemicznymi hydrace.
Chemikalia
Hydracidy są bardzo kwaśnymi roztworami, więc mają protony kwasowe h3ALBO+ dostępne do reakcji z innymi substancjami.
Gdzie powstaje H3ALBO+? Atomu wodoru z dodatnim obciążeniem częściowym δ+, które dysocjuje w wodzie i kończy się kowalencyjnie włączającą do cząsteczki wody:
HX (AC) + H2O (l) x-(AC) + H3ALBO+(AC)
Zauważ, że równanie odpowiada reakcji, która ustanawia równowagę. Kiedy tworzenie x-(AC) + H3ALBO+(AC) jest bardzo uprzywilejowany termodynamicznie, HX zwolni swój proton wody do wody; A potem to, z H3ALBO+ Jako nowy „nosiciel”, możesz zareagować z innym związkiem, nawet jeśli ta ostatnia nie jest silną podstawą.
Powyższe wyjaśnia charakterystykę kwasu hydrace. Dzieje się tak dla wszystkich HX rozpuszczonych w wodzie; ale niektóre generują więcej roztworów kwasowych niż inne. Co to jest? Przyczyny mogą być bardzo skomplikowane. Nie wszystkie HX (AC) sprzyjają poprzednim równowagi po prawej stronie, to znaczy w kierunku x-(AC) + H3ALBO+(AC).
Kwasowość
I wyjątek obserwuje się w kwasie fluorhorycznym, HF (AC). Dlatego fluorka jest bardzo elektroonywana, skracając odległość łącza H-X, wzmacniając ją przed jego pęknięciem przez działanie wodne.
Podobnie, link H-F ma znacznie lepsze nakładanie się z przyczyn radiotelefonów atomowych. Z drugiej strony, łącza H-CL, H-BR lub H-I są słabsze i mają tendencję do całkowicie dysocjowania w wodzie, aż do zerwania z podniesioną równowagą powyżej.
Wynika to z faktu, że inne halogeny lub calcogeny (na przykład siarka) mają większe radiotelefony atomowe, a zatem bardziej nieporęczne orbitale. W konsekwencji łącze H-X przedstawia najbiedniejsze nakładanie się orbity, ponieważ x jest większe, co z kolei ma siłę kwasową, gdy są w kontakcie z wodą.
W ten sposób zmniejszająca się kolejność kwasowości hydracidów halogenowych jest następująca: HF< HCl W postaci bezwodnych, HX (G) należy je wymienić jako podyktowane w przypadku halogenków wodoru: dodanie sufiksu -żubr Na końcu ich nazwisk. Na przykład hi (g) składa się z halogenku (lub wodorku) utworzonego przez wodór i jod, dlatego jego nazwa to: YODżubr wodorowy. Ponieważ zwykle nieMetale nie są bardziej elektroongenacyjne niż wodór, ma liczbę utleniania +1. Z drugiej strony w Nah wodór ma liczbę utleniania -1. Jest to kolejny pośredni sposób różnicowania hydrorów molekularnych od halogenów lub halogenków wodorowych od innych związków. Po hx (g) między kontaktem z wodą jest on reprezentowany jako hx (ac), a następnie ma hydrację. Aby wyznaczyć hydrację, HX (AC), sufiks będzie musiał zostać wymieniony -żubr jego bezwodnych form przy sufiks -Woda. I należy je najpierw wymienić jako kwasy. Zatem dla poprzedniego przykładu HI (AC) jest nazywany: kwasem YODWoda. Hydraceidy można uformować przez proste rozpuszczanie odpowiednich halogenków wodoru w wodzie. Można to przedstawić następującym równaniem chemicznym: Hx (g) => hx (ac) Hx (g) jest bardzo rozpuszczalny w wodzie, więc nie ma równowagi rozpuszczalności, w przeciwieństwie do dysocjacji jonowej w celu uwolnienia kwasu protonów. Istnieje jednak metoda syntetyczna, która jest preferowana, ponieważ stosuje się jako sole surowców lub minerały, rozpuszczając je w niskich temperaturach silnymi kwasami. Jeśli sól stołowa, NaCl, rozpuszcza się ze stężonym kwasem siarkowym, następuje następująca reakcja: NaCl (s) +h2południowy zachód4(ac) => hcl (ac) +nahso4(AC) Kwas siarkowy przekazuje jeden ze swoich protonów kwasowych na chlorek anionowy Cl-, Zmieniając go w kwas solny. Z tej mieszaniny może uniknąć chlorku wodoru, HCl (G), ponieważ jest bardzo lotny, szczególnie jeśli jego stężenie w wodzie jest bardzo wysokie. Drugą wytwarzaną solą jest siarczan kwasu sodu, nahso4. Innym sposobem na jego wytwarzanie jest zastąpienie kwasu siarkowego stężonym kwasem fosforowym: NaCl (s) + h3PO4(ac) => hcl (ac) + nah2PO4(AC) H3PO4 reaguje w taki sam sposób, jak H2południowy zachód4, wytwarzanie fosforanu kwasu sodowego i sodu. NaCl jest źródłem anionu Cl-, aby potrzebne są zsyntetyzowanie innych hydracestów, soli lub minerałów zawierających f-, Br-, Siema-, S2-, itp. Ale użycie H2południowy zachód4 lub h3PO4 Będzie zależeć od jego siły oksydacyjnej. H2południowy zachód4 Jest to bardzo silny środek utleniający, do tego stopnia, że utlenia nawet BR- i ja- do jego molekularnych form BR2 i ja2; Pierwszy to czerwonawy płyn, a drugi fioletowy stał. Dlatego h3PO4 reprezentuje preferowaną alternatywę w takiej syntezy. Hydracidy w istocie są używane do rozpuszczenia innego rodzaju materii. Jest tak, ponieważ są to silne kwasy, a z umiarem mogą wyczyścić dowolną powierzchnię. Ich kwasowe protony są dodawane do związków zanieczyszczeń lub brudu, co czyni je rozpuszczalnymi w środowisku wodnym, a następnie są przeciągane przez wodę. Według chemicznej natury wspomnianej powierzchni można zastosować hydrację lub inną. Na przykład kwas fluorhorowy nie może być stosowany do czyszczenia szkła, ponieważ rozpuściłby je w akcie. Kwas solny służy do usuwania plam na płytkach basenowych. Są również zdolne do rozpuszczenia skał lub próbek stałych, a następnie wykorzystywane do celów analitycznych lub produkcyjnych do małych lub dużych skal. W chromatografii wymiany jonowej rozcieńczony kwas solny stosuje się do czyszczenia pozostałej kolumny jonowej. Niektóre reakcje wymagają bardzo kwaśnych roztworów, aby je przyspieszyć i skrócić czas, który ma miejsce. Tutaj wchodzą hydracidy. Przykładem tego jest zastosowanie kwasu irydowego w syntezie lodowcowego kwasu octowego. Przemysł naftowy potrzebuje również hydracerii w procesach rafinerii. Hydracidy nie tylko dostarczają protonów kwasowych, ale także ich odpowiednich anionów. Te aniony mogą reagować ze związkiem organicznym lub nieorganicznym, tworząc określony halogenk. W ten sposób fluorki, chlorki, jodek. Te halluros mogą mieć bardzo zróżnicowane zastosowania. Na przykład można je wykorzystać do syntezy polimerów, takich jak teflon; lub pośredników, z których atomy halogenowe zostaną włączone do struktur molekularnych niektórych leków. Załóżmy, że cząsteczka ch3Ch2Och, etanol, reaguje z HCl z utworzeniem chlorku etylu: Ch3Ch2OH + HCl => CH3Ch2CL + H2ALBO Każda z tych reakcji ukrywa mechanizm i wiele aspektów rozważanych w syntezie organicznej. Nie ma wielu przykładów dla hydracyzmu, ponieważ liczba możliwych związków jest naturalnie ograniczona. Z tego powodu niektóre dodatkowe hydracidy są wymienione poniżej z odpowiednią nomenklaturą (skrót (AC)) jest ignorowany: Binarny hydraceide, którego cząsteczki H-F tworzą silne mosty wodorowe, do tego stopnia, że w wodzie jest to słaby kwas. W przeciwieństwie do rozważanych hydracidów do tego czasu jest to poliatomiczne, to znaczy ma więcej niż dwa atomy, nadal jest to binarne, ponieważ są to dwa pierwiastki: siarka i wodór i wodór. Jego cząsteczki kątowe H-S-H nie tworzą znaczących mostów wodorowych i mogą być wykryte przez ich charakterystyczną gnicie z zgniłych jaj. Jeden z najbardziej znanych kwasów w kulturze popularnej. Jest to nawet część składu soku żołądka, obecnego w żołądku, i wraz z enzymami trawiennymi degradują pokarm. Jako kwas iarhydralny, w fazie gazowej składa się z cząsteczek liniowych H-Br, które dysocjują jony H+ (H3ALBO+) i Br- Kiedy wchodzą do wody. Chociaż telurio ma pewien metaliczny charakter, jego hydrocencja wydziela nieprzyjemne i niezwykle trujące opary, takie jak kwas seleenhydrowy. A także inna hydracy śladów2-, Więc jego Walencja wynosi -2.Nomenklatura hydracidów
Bezwodna postać
W roztworze wodnym
Jak się mają hydrace?
Bezpośrednie rozwiązanie halogenków wodorowych
Sole nie -metalowe rozpuszczanie kwasami
Zastosowania hydrace
Sprzątacze i rozpuszczalniki
Kwasowe katalizatory
Odczynniki do syntezy związków organicznych i nieorganicznych
Przykłady hydracestów
HF, kwas fluorowy
H2S, kwas sulfhydowy
HCl, kwas solny
HBR, kwas bromhydowy
H2Herbata, kwas telurowy
Bibliografia

