Charakterystyka fenyloalaniny, funkcje, biosynteza, żywność
- 4577
- 1033
- Bertrand Zawadzki
Fenyloalanina (PHE, F) jest jednym z 9 niezbędnych aminokwasów, to znaczy nie jest syntetyzowane endogennie przez ludzkie ciało. W łańcuchu bocznym ten aminokwas ma nie -spolarne aromatyczne związek, który go charakteryzuje.
Fenyloalanina lub kwas propionowy β-fenylo-α-amino po raz pierwszy zidentyfikowano w 1879 r. Przez naukowców J. H. Schulze i m. Barbieri z rośliny z rodziny Fabaceae znanej jako Lupinus luteus lub „żółty altramuz”.
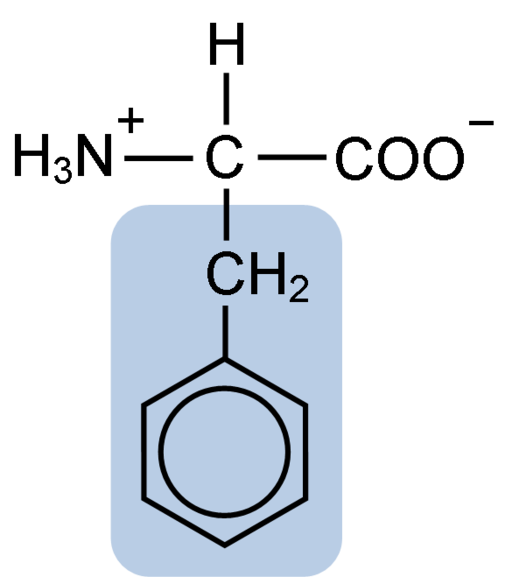
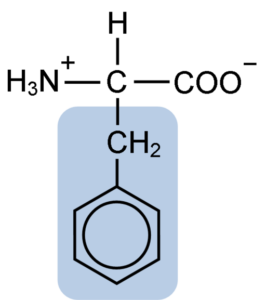 Struktura chemiczna aminokwasowego fenyloalaniny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasowego fenyloalaniny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Dipéptide L-fenyloalanina-l-aspartil jest znany jako aspartam lub „Nutasweet”, który jest słodzącym produkowanym syntetycznie i szeroko stosowanym w restauracjach i kawiarnia.
W owocach o podgrzewanych cechach konwersja L-fenyloalaniny w estrach fenolowych, takich jak eugenol i jej pochodne metaliczne, powoduje powstanie słodkiego zapachu kwiatowego lub podobnego do typowego miodu bananów i owoców bananów, gdy jest dojrzały.
W zależności od postaci fenyloalanina może mieć różne smaki. Na przykład postać L-fenyloalaniny ma słodki aromat i smak, podczas gdy d-fenyloalanina jest lekko gorzka i zwykle tood.
Ponieważ ma silny charakter hydrofobowy, fenyloalanina jest jednym z głównych składników wielu żywic w naturze, takich jak polistyren. Te żywice, w kontakcie z cząsteczkami wody, tworzą strukturę ochronną lub zasięgu znaną jako „trawaty”.
Geny, które kodują drogę biosyntezy fenyloalaniny, są używane przez botaników jako zegarki ewolucyjne, ponieważ stwierdzono, że są one związane z dywersyfikacją morfologiczną roślin lądowych.
[TOC]
Charakterystyka i Struktura
Fenyloalanina dzieli ze wszystkimi aminokwasami grupa karboksylowa (-COH), grupa aminowa (-NH2) i atomem wodoru (-H), które są przyłączone do centralnego atomu węgla znanego jako węgiel α. Ponadto ma łańcuch boczny lub charakterystyczną grupę R.
Fenyloalanina jest jednym z trzech aminokwasów, które mają pierścienie aromatyczne lub benzenowe jako podstawniki w łańcuchach bocznych. Te związki nie są polarne, a zatem są wysoce hydrofobowe.
Aminokwas, o którym mowa, jest szczególnie hydrofobowy, ponieważ w przeciwieństwie do tyrozyny i tryptofanu (pozostałe dwa aminokwasy z pierścieniami aromatycznymi) nie mają grup aminowych ani hydroksylowych zjednoczonych z pierścieniem benzenowym.
Aromatyczna, benzoiczna lub sandyloalanina grupa fenyloalaniny ma typową strukturę benzenu: pierścień cykliczny jest ustrukturyzowany przez 6 atomów węgla, które mają rezonans między nimi ze względu na obecność trzech podwójnych wiązań i trzech prostych wiązań wewnątrz w środku.
W przeciwieństwie do tyrozyny i tryptofanu, które mogą odpowiednio nabierać obciążenie dodatnie i ujemne, fenyloalanina zachowuje obciążenie neutralne, ponieważ pierścień benzenowy nie jest zjonizowany, a obciążenia grup karboksylowych i aminowych neutralizuje się nawzajem.
Klasyfikacja
Aminokwasy są podzielone na różne grupy zgodnie z cechami, jakie mają ich łańcuchy boczne lub grupy R, ponieważ mogą one różnić się wielkością, strukturą, grupami funkcjonalnymi, a nawet ładunkiem elektrycznym.
Jak wspomniano, fenyloalanina jest klasyfikowana w grupie aromatycznych aminokwasów, wraz z tyrozyną i tryptofanem. Wszystkie te związki mają pierścienie aromatyczne w swojej strukturze, jednak tyrozyna i tryptofan mają grupy jonizowalne w podstawkach ich grup R.
Może ci służyć: Specjacja alopatryczna: koncepcja, proces i przykładyCharakterystyka absorpcji światła białkowego przy długości fali 280 nm jest spowodowana obecnością aminokwasów sklasyfikowanych w grupie fenyloalaniny, ponieważ łatwo pochłaniają światło ultrafioletowe przez ich pierścienie aromatyczne.
Wykazano jednak, że fenyloalanina absorbuje się znacznie mniej niż tyrozyna i tryptofan, więc w analizie niektórych białek jej absorbancja jest przewidywalna.
Stereochemia
Wszystkie aminokwasy mają centralny węgiel quiralny, który ma cztery zjednoczone atomy lub grupy i, jak już powiedziano, atom ten jest identyfikowany jako węgiel α. Na podstawie tego węgla można znaleźć co najmniej dwa stereoizomery każdego aminokwasu.
Stereoizomery to cząsteczki z obrazami doniczkowymi, które mają ten sam wzór molekularny, ale które nie pokrywają się ze sobą, na przykład, dłonie i stopy. Związki, które eksperymentalnie obracają prawą spolaryzowaną płaszczyznę światła, są oznaczone literą D, a te, które robią to po lewej stronie, z literą L.
Ważne jest, aby skomentować, że rozróżnienie między formami d-fenyloalaniny i l-fenyloalaniny jest kluczem do zrozumienia metabolizmu tego aminokwasu w ciele kręgowców.
Forma L-fenyloalaniny jest metabolizowana i wykorzystywana do budowy białek komórkowych, podczas gdy D-fenyloalanina znaleziono w krwioobiegu jako środek ochronny przed reaktywnymi formami tlenu (ROS).
Funkcje
W latach 90. uważano, że fenyloalanina była tylko u niektórych gatunków roślin. Jednak dziś wiadomo, że jest obecny w prawie wszystkich hydrofobowych domenach białek, w rzeczywistości fenyloalanina jest głównym składnikiem aromatycznych gatunków chemicznych białek.
U roślin fenyloalanina jest niezbędnym składnikiem wszystkich białek; Ponadto jest to jeden z prekursorów wtórnych metabolitów, takich jak fenylopropanoidy (które są częścią pigmentów) cząsteczek obronnych, flawonoidów, biopolimerów, takich jak lignina i suberina, między innymi.
Fenyloalanina jest podstawową strukturą, która tworzy wiele cząsteczek, które utrzymują homeostazę neuronalną, w tym peptydy, takie jak wazopresyna, melanotropina i encefalina. Ponadto ten aminokwas jest bezpośrednio zaangażowany w syntezę hormonu adrenokortyopowego (ACTH).
Podobnie jak większość aminokwasów białkowych, fenyloalanina jest częścią grupy aminokwasów ketogennych i glukogennych, ponieważ zapewnia szkielet węglowy pośredników cyklu Krebsa, niezbędny do metabolizmu energii komórkowej i ciała.
W nadmiarze fenyloalanina jest przekształcana w tyrozynę, a następnie w fumaran, pośrednik cyklu Krebsa.
Biosynteza
Fenyloalanina jest jednym z niewielu aminokwasów, których nie można syntetyzować przez większość organizmów kręgowców. Obecnie tylko trasy biosyntetyczne znane są z tego aminokwasu w organizmach prokariotycznych, w drożdżach, w roślinach i w niektórych gatunkach grzybów.
Geny odpowiedzialne za drogę syntezy są bardzo zachowane między roślinami i mikroorganizmami, dlatego biosynteza ma podobne kroki u prawie wszystkich gatunków. Nawet niektóre enzymy na trasie występują u niektórych zwierząt, jednak nie są one w stanie go zsyntetyzować.
Biosynteza fenyloalaniny w roślinach
U gatunków roślin fenyloalanina jest syntetyzowana przez wewnętrzną trasę metaboliczną w chloroplastach znanych jako „droga predetenian”. Ta trasa jest metabolicznie związana z „trasą Shikimato”, przez L-arogeneato, jeden z metabolitów wyprodukowanych podczas tego ostatniego.
Może ci służyć: topoizomeraza: co to jest, cechy, funkcje, typyEnzym z infydratasa jest katalizatorem trzech punktów, w którym przekształca aromatyczny pierścień arogenatu w charakterystyczny pierścień benzeniczny fenyloalaniny.
Ten enzym katalizuje transaminację, odwodnienie i dekarn.
Prenenian obok nagromadzonego fenylopirogronianu wewnątrz (światło) chloroplastu można przekształcić na fenyloalaninę przez reakcję katalizowaną przez enzym aminotransferazę propenato, który przenosi grupę aminową na fenylopyrogan, tak że jest rozpoznawana przez dehydratazę arogenianową, a jest włączona. do syntezy fenyloalaniny.
W niektórych gatunkach Pseudomonas Alternatywne trasy zostały opisane z sendą profenato, które wykorzystują różne enzymy, ale których substraty do syntezy fenyloalaniny są również predetenian i arogenian.
Degradacja
Fenyloalanina może być metabolizowana na wiele sposobów od jedzenia. Jednak największa ilość badań koncentruje się na ich miejscu docelowym na komórkach tkanek nerwowych i tkankach nerkowych.
Wątroba jest głównym narządem do degradacji lub katabolizmu fenyloalaniny. W hepatocytach istnieje enzym znany jako hydroksylaza fenyloalanina, zdolna do przekształcania fenyloalaniny w tyrozynę lub w złożonym L-3,4-dihydroksyfenyloalaninie (L-Dopa).
Związek L-Dopa jest prekursorem noradrenaliny, epinefryny i innych hormonów i peptydów z aktywnością w układzie nerwowym.
Fenyloalaninę można utleniać w komórkach mózgowych za pomocą enzymu hydroksylazy tyrozynowej, który jest odpowiedzialny za katalizowanie konwersji fenyloalaniny do dopakromu w obecności kwasu l-akorbinowego.
Wcześniej uważano, że hydroksylazy hydroksylazy tyrozynowej tylko tyrozyna, stwierdzono, że ta fenyloalanina i hydroksyle tyrozyny w tej samej proporcji i że hydroksylacja fenyloalaniny hamuje hydroksylację tyrozynową.
Obecnie wiadomo, że wysokie proporcje tyrozyny hamują aktywność enzymatyczną tyrozyny hydroksylazy, ale to samo nie dotyczy fenyloalaniny.
Pokarmy bogate w fenyloalaninę
Wszystkie pokarmy bogate w białko mają zawartość fenyloalaniny między 400 a 700 mg dla części spożywanej żywności. Pokarmy takie jak olej dorszowy, świeży tuńczyk, homary, ostrygi i inne małże, zawierają więcej niż 1.000 mg na część połkniętej żywności.
Mięso bydlęce i świńskie mają również wysoki poziom fenyloalaniny. Nie są jednak tak wysokie jak stężenia obecne u zwierząt morskich. Na przykład produkty boczku, wołowiny, wątroby, kurczaka i nabiału mają od 700 do 900 mg fenyloalaniny przez racja żywności.
Orzech, takie jak orzeszki ziemne i orzechy różnych typów, to inne pokarmy, które mają dużą ilość fenyloalaniny. Ziarna, takie jak soja, ciecierzyca i inne rośliny strączkowe, mogą zapewnić od 500 do 700 mg fenyloalaniny według porcji.
Jako alternatywne źródło fenyloalanina może być metabolizowana z aspartamu.
Korzyści z Twojego spożycia
Fenyloalanina występuje we wszystkich spożywanych przez nas żywności białko. Minimalne dzienne spożycie dla dorosłych i średnia wielkość wynosi około 1000 mg, niezbędna do syntezy białek, hormonów, takich jak dopamina, różnych neuroprzekaźników itp.
Może ci służyć: jaka jest naturalna różnorodność ziemi?Spożywanie tego nadmiaru aminokwasu jest przepisywane osobom z zaburzeniami depresyjnymi, bólem stawów i chorób skóry, ponieważ jego spożycie zwiększa syntezę białka i przenoszenie biomolekuł, takich jak epinefryna, noradrenalina i dopamina.
Niektóre badania sugerują, że fenyloalanina spożywana w nadmiarze nie powoduje znacznej poprawy w żadnym z tych zaburzeń, ale ich konwersja na tyrozynę, która jest również stosowana do syntezy cząsteczek sygnalizacyjnych, może wyjaśniać pozytywny wpływ na sygnalizację komórkową w układzie nerwowym w układzie nerwowym w układzie nerwowym w układzie nerwowym w układzie nerwowym w układzie nerwowym w układzie nerwowym w układzie nerwowym system nerwowy.
Leki sformułowane przeciwko zaparciom mają jądra ustrukturyzowane przez fenyloalaninę, tyrozynę i tryptofan. Zasadniczo leki te zawierają mieszaniny tych trzech aminokwasów w ich postaci-.
Zaburzenia niedoboru
Poziomy fenyloalaniny krwi są ważne dla utrzymania właściwego funkcjonowania mózgu, ponieważ fenyloalanina, tyrozyna i tryptofan są substratami do montażu różnych neuroprzekaźników.
Niektóre zaburzenia odnoszą się raczej z deficytami w metabolizmie tego aminokwasu, który generuje nadmiar, zamiast niedoboru.
Feniloketonuria, niezwykła dziedziczna choroba u kobiet, wpływa na hydroksylację fenyloalaniny w wątrobie i powoduje, że poziomy tego aminokwasu w osoczu jest nadmierne.
Jeśli kobieta z fenyloketonurią zajdzie w ciążę, płód może przedstawić tak zwany „hiperfenyloalaninemia„ zespół płodu ”.
Wynika to z faktu, że płód ma wysokie stężenie fenyloalaniny we krwi (prawie dwukrotnie wyższe niż standardy), którego pochodzenie jest związane z brakiem hepatycznej hydroksylazy fenyloalaniny płodu, która nie rozwija się dopiero 26 tygodni ciążowania.
Zespół płodu przez hiperfenyloalaninemię matczyną, wytwarza mikroghalalia płodu, nawracające aborcje, choroby serca, a nawet wady nerkowe.
Bibliografia
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, L.,… & Micu, r. (2018). Wykrywanie i zmiatanie rodników hydroksylowych poprzez hydroksylację D-fenyloalaninę w ludzkich płynach. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, d. L., Laskar, d. D., ANTEROLA, a. M.,… & Kang, c. (2007). Biosynteza fenyloalaniny w Thalian Arabidopsis Identyfikacja i charaktercja argenian odwadniczych. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Synteza i funkcjonowanie w mózgu i funkcjonowanie w mózgu i funkcjonowanie tyrozyny, fenyloalaniny i. The Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, J., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., I Willner, ja. (2018). Katalizowane i elektrokatalizowane utlenianie L-tyrozyny i L-fenyloalaniny do dopachromu przez nanozymy. Nano Letters, 18 (6), 4015-4022.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Perkins, r., & Vaida, v. (2017). Fenyloalanina zwiększa przepuszczalność błony. Journal of the American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. DO. (1912). Konstytucja chemiczna białek (vol. 1). Longmans, zielony.
- Tensley, g. (2018). LILINE. Pobrano 5 września 2018 r. Z www.LILINE.com/odżywianie/fenyloalanina
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, do. R. (2013). Biosynteza shikimate i fenyloalaniny w zielonej linii. Frontiers in Plant Science, 4, 62.
- « Charakterystyka izoleucyny, funkcje, biosynteza, żywność
- Charakterystyka frontu krajowego, cele, prezydenci »

