Charakterystyka izoleucyny, funkcje, biosynteza, żywność
- 4017
- 1062
- Prokul Woliński
izoleucyna (Ile, i) jest jednym z 22 aminokwasów obecnych w naturze jako część białek. W związku z faktem, że ludzkie ciało, podobnie jak w przypadku niektórych innych ssaków, nie może go zsyntetyzować, izoleucyna jest jednym z 9 niezbędnych aminokwasów, które należy uzyskać za pomocą diety.
Ten aminokwas został wyizolowany po raz pierwszy w 1903 roku przez naukowca F. Ehrlich z składników azotu z buraków lub melasy buraków. Następnie ten sam autor oddzielił izoleucynę od produktów rozkładu fibryny i innych białek.
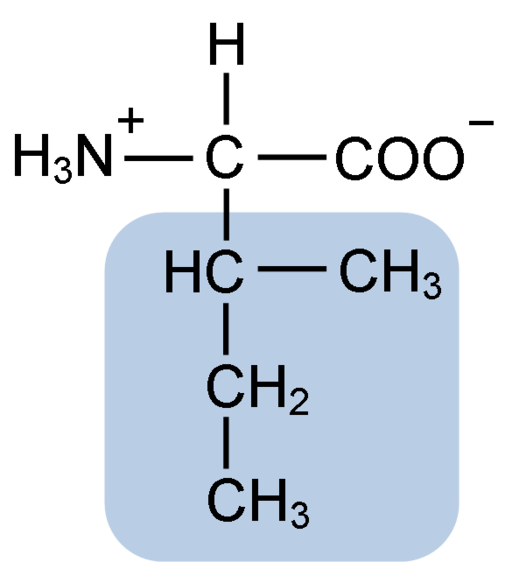
 Struktura chemiczna aminokwasu izoleucyny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasu izoleucyny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Jest to nie -spolarne aminokwas obecny w większości białek komórkowych żywych organizmów, a ponadto jest częścią rozgałęzionych aminokwasów łańcuchowych BCAAS (z angielskiego BRanczo CHain DOMój nie DOCIDS), Wraz z Leuciną i Valiną.
Ma funkcje w tworzeniu trzeciorzędowej struktury wielu białek, a ponadto uczestniczy w tworzeniu różnych prekursorów metabolicznych związanych z metabolizmem energii komórkowej.
[TOC]
Charakterystyka
Isoleucyna jest klasyfikowana w ramach grupy aminokwasowej nieolarnej z grupami lub łańcuchami natury aifatycznej, to znaczy z łańcuchami węglowodorowymi węglowodorowymi.
Z powodu tej charakterystyki aminokwasy tej grupy, takie jak alanina, valina i leucina, pozostają blisko siebie, co przyczynia się do stabilizacji białek, które są częściowo za pomocą interakcji hydrofobowych.
Ten nie -spolarowany aminokwas waży około 131 g/mol i jest obecny w białkach w proporcji blisko 6%, często „zakopywanych” w ich środku (dzięki jego właściwościom hydrofobowym).
Struktura
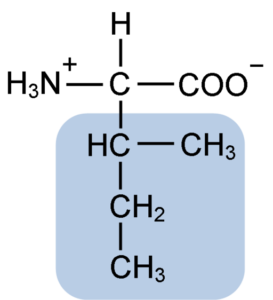
Isoleucyna jest α-aminokwasem, który, podobnie jak inne aminokwasy, ma centralny atom węgla o nazwie α (który jest chiralny), do którego połączono cztery różne grupy: atom wodoru, grupa aminowa (-NH2), A, a grupa karboksylowa (-COH) i łańcuch boczny lub r Grupo.
Grupa izoleucyny R składa się z prostego rozgałęzionego węglowodoru 4 atomów węgla (-ch3-ch2-ch2 (CH3)), w którego łańcuchu znajduje się również quiralny atom węgla.
Ze względu na tę charakterystykę izoleucyna ma cztery możliwe sposoby: dwa z nich to izomery optyczne zwane L-izoleucyna i izoleucyna D, a pozostałe dwa to diastereoizomery L-izoleucyny L-izoleucyny. Dominującą postacią w białkach jest L-izoleucyna.
Molekularna wzór izoleucyny to C6H13NO2, a jej chemiczna nazwa to α-amino-β-metylo-β-etylopropionowe lub 2-amino-3-metylo-pentatoniczne kwas kwasu kwasu kwaśnego lub kwasu kwaśnego.
Funkcje
Izoleucyna ma wiele funkcji fizjologicznych u zwierząt, w tym
- Gojenie się ran
- Detoksykacja odpadów azotowych
- Stymulacja funkcji odpornościowych i
- Promowanie wydzielania różnych hormonów.
Jest uważany za aminokwas glikogenny, ponieważ służy jako cząsteczka prekursorowa do syntezy pośredników cyklu kwasu cytrusowego (cykl Krebsa), który następnie przyczynia się do tworzenia glukozy w wątrobie.
Z tego powodu uważa się, że izoleucyna uczestniczy w regulacji poziomów glukozy w osoczu, co ma ważne implikacje z punktu widzenia energii ciała.
Isoleucyna przyczynia się do szlaków syntezy glutaminy i alaniny, działając na korzyść równowagi między rozgałęzionymi aminokwasami łańcuchowymi.
W dziedzinie klinicznej niektórzy autorzy wskazują, że wzrost stężenia izoleucyny, leucyny, tyrozyny i waliny może być charakterystycznymi markerami komórek dotkniętych guza, a następnie wzrost poziomu glutaminy.
Inne funkcje
Różne badania naukowe wykazały, że izoleucyna jest niezbędna do syntezy hemoglobiny, białka odpowiedzialnego za transport tlenu we krwi wielu zwierząt.
Ponadto ten aminokwas aktywuje wejście składników odżywczych do komórek; Niektóre badania pokazują, że podczas przedłużonego postu jest w stanie zastąpić glukozę jako źródło energii, a ponadto jest ketogennym aminokwasem.
Może ci służyć: harmonogram biologiiKetogeniczne aminokwasy to te, których szkielety węglowe mogą być przechowywane, takie jak kwasy tłuszczowe lub węglowodany, więc działają w rezerwacie energii.
Izoleucyna i inne rozgałęzione aminokwasy (oprócz czynników wzrostu i warunków środowiskowych) pracują nad aktywacją białej lub docelowej drogi sygnalizacyjnej rapamycyny, mTOR (z angielskiego MTananistyczny TArget alboF RApamycyna).
Ta trasa jest ważną drogą sygnalizacyjną w eukariotach zdolnych do kontrolowania wzrostu komórek i metabolizmu, a także syntezy białek i zdarzeń autofagii. Ponadto kontroluje postęp starzenia się i niektóre patologie, takie jak rak lub cukrzyca.
Biosynteza
Ludzie i inne zwierzęta nie są w stanie syntetyzować izoleucyny, ale jest to część białek komórkowych dzięki ich pozyskiwaniu od żywności, którą spożywamy codziennie.
Rośliny, grzyby i większość mikroorganizmów są w stanie syntetyzować ten aminokwas z nieco złożonych tras, które zwykle są powiązane z innymi aminokwasami, również uważane za niezbędne dla człowieka.
Istnieją na przykład sposoby wytwarzania izoleucyny, lizyny, metioniny i treminy z asparaginianu.
W szczególności w bakteriach izoleucyna jest wytwarzana z aminokwasu treoniny, przez pirogronian, drogą implikującą kondensa 2 węgli pirogronianowych z cząsteczką αekthobutiruratu, który wywodzi się z tremeriny.
Reakcja rozpoczyna się od działania dehydratazy enzymu, która katalizuje odwodnienie tremeniny w celu wytworzenia α-akotobutiratu i amonu (NH3). Następnie te same enzymy, które uczestniczą w biosyntezy Valine, przyczyniają się do kroków
- Transaminacja
- Oksydacyjna dekarboksylacja odpowiednich ketoacidów i
- Odwodnienie.
W tego rodzaju mikroorganizmach synteza aminokwasów, takich jak lizyna, metionina, treonina i izoleucyna jest bardzo skoordynowana i regulowana, szczególnie przez ujemne sprzężenie zwrotne, w których produkty reakcji hamują aktywność zaangażowanych enzymów.
Chociaż izoleucyna, podobnie jak leucyna i walina, są niezbędnymi aminokwasami dla człowieka, enzymy aminotransferae obecne w tkankach ciała mogą je odwrócić odwracalnie do odpowiadających im α-ZO-SOATS, które mogą ostatecznie zastąpić je w dietetycznej.
Degradacja
Jako duża część aminokwasów znanych w naturze, izoleucyna może być zdegradowana w celu tworzenia pośredników różnych dróg metabolicznych, w tym cykl Krebsa (który zapewnia największą ilość koenzymów, które działają w celu produkcji energii lub do biosyntezy innych związków ).
Zarówno izoleucyna, jak i tryptofan, lizyna, fenyloalanina, tyrozyna, treonina i leucyna mogą być stosowane do wytworzenia acetylo-CoA, kluczowego metabolicznego pośredniego dla wielu reakcji komórkowych.
W przeciwieństwie do innych aminokwasów, rozgałęzione aminokwasy łańcuchowe (leucyna, izoleucyna i walina) nie są degradowane w wątrobie, ale utleniają się jako paliwa w mięśniach, mózgu, nerkach i tkance tłuszczowej.
Te narządy i tkanki mogą używać tych aminokwasów dzięki obecności enzymu aminotransferazy zdolnego do działania na trzy i wytwarzanie odpowiadających im aminokwasów α-Zo.
Po wytworzeniu tych utlenionych aminokwowych pochodnych α-Zo-ketoacidowy kompleks enzymatyczny katalizuje ich dekarboksylację oksydacyjną, w której uwalnia cząsteczkę dwutlenku węgla (CO2) i wytwarza pochodną acylo-CoA na kwestię aminokwasów aminokwasów.
Patologie związane z metabolizmem izoleucyny
Wady metabolizmu izoleucyny i innych aminokwasów mogą powodować różnorodność dziwnych i złożonych patologii, takich jak choroba „”Mocz syropu klonowego”(Mocz z syropem arce) lub rozgałęziony ketoaciduria.
Jak sama nazwa wskazuje, choroba ta charakteryzuje się charakterystycznym aromatem moczu pacjentów, którzy cierpią na nią, oprócz wymiotów, napadów, upośledzenia umysłowego i przedwczesnej śmierci.
W szczególności musi to zrobić z błędami w kompleksie enzymatycznej dehydrogenazy α-cetoacidowej, tak że rozgałęzione aminokwasy łańcuchowe, takie jak izoleucyna i jej utlenione pochodne, są wydalane w moczu.
Może ci służyć: Tafonomia: History, Ochrony i Zmiana kopalnychRazem patologie związane z katabolizmem rozgałęzionych aminokwasów łańcuchowych, takich jak izoleucyna, są znane jako kwas ekologiczny, chociaż te, które są bezpośrednio związane z tym aminokwasem, są dość rzadkie.
Pokarmy bogate w izoleucynę
Ten aminokwas jest obfity w tkankach mięśniowych zwierząt, tak że mięso pochodzenia zwierzęcego, takie jak krowa, wieprzowina, ryby i inne podobne, takie jak jagnięcina, kurczak, indyk, jelenie, są bogate w to samo.
Znajduje się również w nabiałach i jego pochodnych, takich jak ser. Jest w jajach, a także w różnych rodzajach nasion i orzechów, jako istotna część białek, które je tworzą.
Jest obfity w soi i groszku, a także w ekstraktach drożdży używanych w różnych celach żywnościowych.
Poziomy izoleucyny w osoczu dla dorosłego człowieka wynosi od 30 do 108 μmol/l, dla dzieci i młodych ludzi w wieku od 2 do 18 lat wynosi od 22 do 107 μmol/l, a dla niemowląt od 0 do 2 lat między 26 i 86 μmol/l.
Dane te sugerują, że spożywanie bogatej żywności w tych i innych powiązanych aminokwasach jest niezbędne do utrzymania wielu funkcji fizjologicznych organizmu, ponieważ ludzie nie są w stanie go zsyntetyzować Novo.
Korzyści z Twojego spożycia
Suplementy diety z izoleucyną zwykle zawierają inne niezbędne aminokwasy o rozgałęzionym łańcuchu, takie jak walina, leucyna lub inne.
Do najczęstszych przykładów zużycia izoleucyny są suplementy diety stosowane przez sportowców w celu zwiększenia odsetka masy mięśniowej lub syntezy białek. Jednak podstawa naukowa, na której obsługiwane są te praktyki, są stale omawiane, a ich wyniki nie są w pełni gwarantowane.
Isoleucyna jest jednak stosowana do przeciwdziałania efektom metabolicznym niedoboru witaminy (PELAGRA) charakterystycznej dla pacjentów, którzy mają bogate diety sorgo i kukurydzy, które są pokarmami o wysokiej zawartości leucyny, które mogą wpływać na metabolizm tryptofanu i kwasu nikotynowego u ludzi.
Na przykład wpływ pelagry na szczury eksperymentalne obejmują opóźnienia wzrostu, które są przezwyciężone z suplementacją izoleucyny.
- W branży produkcji zwierząt
W obszarze produkcji zwierząt aminokwasy, takie jak lizyna, treonina, metionina i izoleucyna, zastosowano w testach pilotażowych do karmienia świń.
W szczególności izoleucyna wydaje się mieć wpływ na asymilację azotu, chociaż nie przyczynia się do przyrostu masy tych zwierząt hodowlanych.
- W niektórych stanach klinicznych
Niektóre publikacje sugerują, że izoleucyna jest w stanie obniżyć poziom glukozy w osoczu, więc ich spożycie jest zalecane u pacjentów cierpiących na zaburzenia, takie jak cukrzyca lub niskie wskaźniki produkcji insuliny.
Infekcje wirusowe
Suplementacja isooleucyny okazała się przydatna u pacjentów zakażonych rotawirusem, które powodują choroby, takie jak zapalenie żołądka i biegunka u małych dzieci i innych młodych zwierząt.
Ostatnie badania stwierdzają, że spożywanie tego aminokwasu przez zwierzęta eksperymentalne o wyżej wymienionych cechach (zakażone rotawirusem) pomaga w rozwoju i wydajności wrodzonego układu odpornościowego dzięki aktywacji dróg sygnalizacyjnych PRR lub receptorów z rozpoznawaniem rozpoznawania rozpoznawania za rozpoznawanie za rozpoznawanie Wzory.
Zaburzenia niedoboru
Niedobór izoleucyna może zawierać problemy w widzeniach, skórze (takich jak zapalenie skóry) i jelicie (widoczne jako biegunka i inne objawy żołądkowo -jelitowe)))).
W związku z faktem, że jest to niezbędny aminokwas do tworzenia i syntezy hemoglobiny, a także dla regeneracji erytrocytów (komórki krwi), poważne niedobory izoleucyny mogą mieć poważne konsekwencje fizjologiczne, szczególnie związane z niedokrwistością i innymi hematologicznymi i innymi hematologicznymi choroby.
Może ci służyć: trzeciorzędni konsumenciZostało to eksperymentalnie wykazane w „normalnych” gryzoniach, do których w tej izoleucynie zapewniono słabe diety, która kończy się rozwojem ważnych obrazów anemicznych.
Jednak izoleucyna uczestniczy w tworzeniu hemoglobiny tylko u niemowląt, ponieważ białko dorosłego człowieka nie ma istotnych ilości takiego aminokwasu; Oznacza to, że brak izoleucyny jest bardziej widoczny na pierwszych etapach rozwoju.
Bibliografia
- Aders Plimmer, r. (1908). Konstytucja chemiczna białek. wyszedłem. Londyn, Wielka Brytania: Longmans, Green i Co.
- Aders Plimmer, r. (1908). Konstytucja chemiczna białek. część druga. Londyn, Wielka Brytania: Longmans, Green i Co.
- Barret, g., & Elmore, D. (2004). Aminokwasy i peptydy. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, k. (1996). Przewodnik dla lekarza po diagnozie laboratoryjnej chorób metabolicznych (2 wyd.).
- Bradford, godz. (1931). Historia odkrycia aminokwasów. Ii. Przegląd aminokwasów opisanych od 1931 r. Jako składniki natywnych białek. Postęp w chemii białek, 81-171.
- Campos-Ferraz, s. 1. L., Bozza, t., Nicastro, godz., & Łódź, do. H. (2013). Wyraźne działanie leucyny lub mieszaniny rozgałęzionego aminokwasu (leucyna, izoleucyny i waliny) suplementacji oporności na zmęczenie oraz degradację mięśni i glikogenu wątroby, u wyszkolonych szczurów szczurów szczurów. Odżywianie, 29(11-12), 1388-1394.
- Champe, str., & Harvey, r. (2003). Aminokwasy aminokwasy. W Ilustrowane recenzje Lippincott: Biochemia (Wyd., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, m. (1951). Aminokwas i białka w tworzeniu hemoglobiny 2. Izoleucyna. Journal Biochemical, 49, 393-398.
- Chung, a. S., & Beames, r. M. (1974). Lysina, treonina, metionina i izoleucyna suplementacja jęczmienia River Peace dla rosnących świni. Pies. J. Anim. Sci., 436, 429-436.
- DeJong, c., Meijerink, w., Van Berlo, C., Deutz, n., & Soeters, p. (1996). Początkowe stonery izoleucyny w osoczu po górnym krwotoku żołądka u ludzi. JELITO, 39, 13-17.
- Edsall, J. (1960). Aminokwasy, białka i biochemia raka (Tom. 241). Londyn: Academic Press, Inc.
- Britannica Encyclopaedia. (2012). Pobrano 30 sierpnia 2019 r. Z https: // www.Britannica.com/science/izoleucyna
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Węglowodany w diecie i metabolizm połkniętego białka. Nazwa naukowego czasopisma medycznego, 65-68.
- Hudson, ur. (1992). Biochemia białek żywnościowych. Springer-Science+Business Media, b.V.
- Knerr, ja., Vockley, J., & Gibson, k. M. (2014). Zaburzenia metabolizmu leucyny, izoleucyny i waliny. Zajazd. Blau (wyd.), Przewodnik po diagnozie, leczeniu i obserwacji dziedzicznych chorób metabolicznych (PP. 103-141).
- Korman, s. H. (2006). Wrodzone błędy degradacji izoleucyny: przegląd. Genetyka molekularna i metabolizm, 89(4), 289-299.
- Krishnaswamy, k., & Gpalan, c. (1971). Wpływ izoleucyny na skórę i elektroencefalogram w Pellagra. Nazwa naukowego czasopisma medycznego, 1167-1169.
- Martin, r. I., & Kirk, k. (2007). Transport izoleucyny składników odżywczych w ludzkich erytrocytach zakażonych malarią pasożyta Plasmodium falciparum. Krew, 109(5), 2217-2224.
- National Center for Biotechnology Information. Baza danych Pubchem. L-izoleucyna, CID = 6306, https: // pubchem.NCBI.NLM.Nih.Gov/Compund/L-izoleucyna (dostęp do sierpnia. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, m. C. (2008). Wpływ doustnie podawanej izoleucyny z glukozą i bez nich na stężenie insuliny, glukagonu i glukozy u osób bez cukrzycy. Europejski e-kournal klinicznego żywienia i metabolizmu, 3(4), 152-158.
- Van Berlo, C. L. H., Van de Bogaard, do. I. J. M., Van der heijden, m. DO. H., Van Eijk, H. M. H., Janssen, m. DO., Bost, m. C. F., & Soeters, p. B. (1989). To rzędne wyzwolenie amoniaku po krwawieniu w przewodzie pokarmowym ujmowanie całkowitego braku izoleucyny w hemoglobinie? Badanie u świń. Hepatologia, 10(3), 315-323.
- Vickery, h. B., & Schmidt, c. L. DO. (1931). Historia odkrycia aminokwasów. Recenzje chemiczne, 9(2), 169-318.
- Wolfe, r. R. (2017). Synteza gałęzionego łańcucha i synteza białek mięśniowych u ludzi: mit lub rzeczywistość? Journal of International Society of Sports Nutrition, 14(1), 1-7.
- Wu, g. (2009). Aminokwasy: metabolizm, funkcje i odżywianie. Aminokwasy, 37(1), 1-17.
- « Historia ekologii przemysłowej, cele, przykłady
- Charakterystyka fenyloalaniny, funkcje, biosynteza, żywność »

