PI Link
- 731
- 33
- Pani Gilbert Stolarczyk
Wyjaśniamy, czym jest link PI, jak powstają jego cechy, i podajemy kilka przykładów
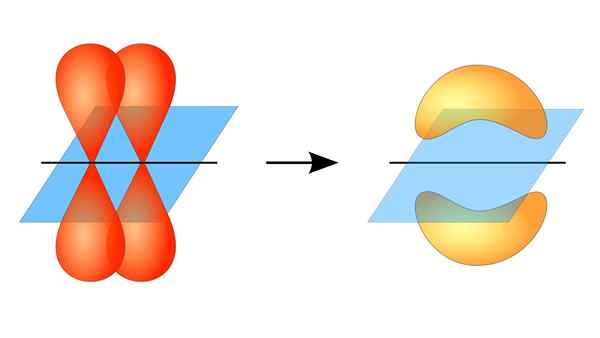
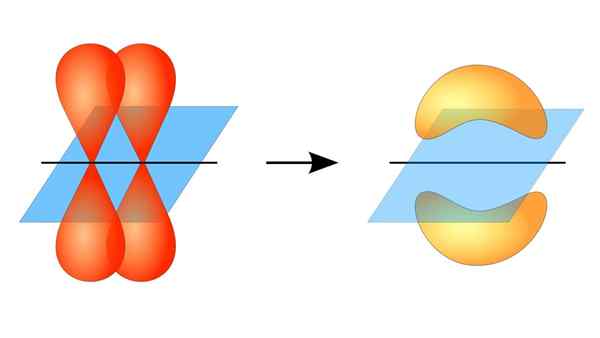 Dwa orbitale p tworzą link π
Dwa orbitale p tworzą link π Co to jest link PI?
A PI Link (π) Jest to kowalencyjny rodzaj ogniwa charakteryzującego się przez zapobieganie ruchowi atomów swobodnego i pochodzącego między parą czystych orbitali atomowych, między innymi osobliwościami. Istnieją linki, które mogą być uformowane między atomami przez ich elektrony, które pozwalają im budować większe i bardziej złożone struktury: cząsteczki.
Te linki mogą mieć różne odmiany, ale najczęstsze w tej dziedzinie badań są kowalencyjne. Wiązania kowalencyjne, zwane również molekularnymi, są rodzajem ogniwa, w którym zaangażowane atomy dzielą pary elektronów.
Może się to wystąpić z powodu potrzeby poszukiwania stabilności atomów, tworząc w ten sposób większość znanych związków. W tym sensie wiązania kowalencyjne mogą być proste, podwójne lub potrójne, w zależności od konfiguracji ich orbitali i ilości par elektronów dzielonych między zaangażowanymi atomami.
Właśnie dlatego istnieją dwa rodzaje kowalencyjnych wiązań, które powstają między atomami oparte na orientacji ich orbitali: łącza sigma (σ) i łącza PI (π) (π).
Ważne jest, aby odróżnić oba łącza, ponieważ łącze Sigma jest prezentowane w prostych związkach, a PI w wielu związkach między atomami (udostępniane są dwa lub więcej elektronów).
Jakie są formy PI Link?
Aby opisać tworzenie linku PI, należy go najpierw omówić na temat procesu hybrydyzacji, ponieważ interweniuje w niektórych ważnych linkach.
Hybrydyzacja to proces, w którym powstają hybrydowe orbitale elektroniczne; to znaczy, gdzie można mieszać orbitale z poziomu atomowego. To powoduje tworzenie orbitali SP, SP2 i sp3, które nazywane są hybrydami.
Może ci służyć: odwracalna reakcja: charakterystyka i przykładyW tym sensie powstawanie linków PI występuje dzięki nakładaniu się kilku płatów należących do orbity atomowej na innej parie płatów, które znajdują się na orbicie, która jest częścią innego atomu atomu.
To nakładanie się orbity zachodzi bocznie, więc rozkład elektroniczny jest skoncentrowany głównie powyżej i poniżej płaszczyzny, która tworzy połączone jądra atomowe i powoduje słabsze wiązania PI niż wiązania Sigma.
Mówiąc o symetrii orbitalnej tego typu zjednoczenia, należy wspomnieć, że jest on równy symbolicznej orbitali P. Ponadto związki te są w większości utworzone przez orbitale p.
Tworzenie wiązań Pi u różnych gatunków chemicznych
Ponieważ wiązaniom PI zawsze towarzyszy jedno lub dwa kolejne łącza (jeden sigma lub drugi PI i jeden sigma), istotne jest wiedzieć, że podwójne wiązanie utworzone między dwoma atomami węgla (utworzone przez wiązanie Sigma i jeden PI) ma niższą energię łącza niż ta odpowiadająca dwukrotnie łączowi Sigma między dwoma.
Wyjaśnia to stabilność łącza sigma, która jest większa niż w przypadku wiązania PI, ponieważ nakładanie się orbitali atomowych w tym ostatnim występuje równolegle w regionach powyżej i pod płatami, gromadząc rozkład elektroniczny w dalszej części atomowej jądra.
Mimo to, gdy łącza PI i Sigma są łączone wielokrotnie głośniejsze link niż sam prosty link, który można zweryfikować, obserwując długości linków między różnymi atomami z prostymi i wieloma linkami.
Może ci służyć: tlenki nie -metaloweIstnieją niektóre gatunki chemiczne, które są badane przez ich wyjątkowe zachowanie, takie jak związki koordynacyjne z pierwiastkami metali, w których atomy centralne są zjednoczone tylko przez wiązania PI.
Charakterystyka łącza PI
Nie pozwala na swobodny ruch obrotowy atomów
Charakterystyka, które odróżniają łącza PI od innych rodzajów interakcji między gatunkami atomowymi, opisano poniżej, poczynając od faktu, że ten związek nie pozwala na ruch wolnego obrotu atomów, takich jak węgiel. Z tego powodu, jeśli istnieje obrót atomów, występuje pęknięcie wiązania.
Nakładaj się między orbitalami w dwóch równoległych regionach
Podobnie w tych linkach nakładanie się orbitali odbywa się przez dwa równoległe regiony, dzięki czemu mają większą dyfuzję niż wiązania sigma i że z tego powodu są słabsze.
Między kilkoma czystymi orbitaliami atomowymi
Z drugiej strony, jak wspomniano powyżej, łącze PI jest zawsze generowane wśród pary czystych orbitali atomowych; Oznacza to generowane wśród orbitali, które nie doznały procesów hybrydyzacji, w których gęstość elektronów jest głównie skoncentrowana powyżej i poniżej płaszczyzny utworzonej przez Związek Kowalencyjny.
W tym sensie więcej niż jedno link PI można przedstawić wśród kilku atomów, zawsze towarzyszy łącze Sigma (w podwójnych wiązaniach).

Podobnie możesz podać potrójne połączenie między dwoma sąsiednimi atomami, które powstają dwa wiązania PI w pozycjach, które tworzą ze sobą prostopadłe płaszczyzny i łącznik sigma między dwoma atomami.
Może ci służyć: kwas huminowy: struktura, właściwości, uzyskiwanie, zastosowaniaPrzykłady linków PI
Cząsteczka etylenu
Jak wspomniano wcześniej, cząsteczki utworzone przez zjednoczone atomy przez jeden lub więcej wiązań PI zawsze mają wiele linków; to znaczy podwójne lub potrójne.
Przykładem tego jest cząsteczka etylenu (h2C = CH2), który składa się z podwójnego związku; Oznacza to, że wiązanie PI i jedno sigma między jego atomami węgla, oprócz wiązań sigma między węglemi i hydrogenami.
Cząsteczka acetylenu
Ze swojej strony cząsteczka acetylenu (H-C≡C-H) ma potrójne połączenie między jej atomami węgla; Oznacza to, że dwa wiązania PI tworzące prostopadłe płaszczyzny i wiązanie sigma, oprócz odpowiadających im wiązań węglowych-hydrogenów.
Benzen i pochodne
Przedstawiono również wiązania PI między cząsteczkami cyklicznymi, takie jak benzen (C6H6) i jego pochodne, których dyspozycja powoduje efekt zwany rezonansem, który umożliwia migrację gęstości elektronicznej między atomami i dotacją, większą stabilność związku.
Dikarbon
Aby zilustrować wspomniane wcześniej wyjątki, przypadki cząsteczki dikarbonalu (C = C, w której oba atomy mają parę sparowanych elektronów) i związek koordynacyjny zwany heksakarbonildihierro (reprezentowane jako wiara2(WSPÓŁ)6, który jest tworzony tylko przez PI Links między jego atomami).

