Helmholtz Free Energy jednostki, sposób obliczania, rozwiązanych ćwiczeń

- 2975
- 849
- Estera Wojtkowiak
Helmholtz Free Energy Jest to potencjał termodynamiczny, który mierzy użyteczną pracę systemu zamkniętego w stałej temperaturze i objętości. Bezpłatna energia Helmholtza jest oznaczona jako F I jest zdefiniowany jako różnica od energii wewnętrznej LUB mniej produktu temperaturowego T Dla entropii S:
F = u - tarcie
Ponieważ jest to energia, jest mierzona w dżuli w systemie międzynarodowym (SI), chociaż inne odpowiednie jednostki mogą być również ergios (CGS), kalorie lub wolty elektronowe (EV).
 Rysunek 1. Definicja energii Helmholtza. Źródło: Pixabay.
Rysunek 1. Definicja energii Helmholtza. Źródło: Pixabay. Ujemna zmienność energii Helmholtza podczas procesu jest utożsamiana z maksymalną pracą, którą system może wykonywać w procesie izokorycznym, to znaczy do stałej objętości. Gdy objętość nie jest stała, część tej pracy można wykonać w środowisku.
W takim przypadku odnosimy się do pracy, w której objętość nie różni się, taka jak praca elektryczna: dw = φdq, z φ jako potencjał elektryczny i q jako ładunek elektryczny.
Jeśli temperatura jest również stała, energia Helmholtza jest zminimalizowana po osiągnięciu równowagi. Mimo to energia Helmholtza jest szczególnie przydatna w procesach o stałej objętości. W takim przypadku masz:
- Dla spontanicznego procesu: ΔF < 0
- Gdy układ jest w równowadze: ΔF = 0
- W procesie niestabilnym: ΔF> 0.
[TOC]
Jak obliczana jest Helmholtz Free Energy?
Jak stwierdzono na początku, energia Helmholtza jest definiowana jako „energia wewnętrzna lub system, z wyjątkiem iloczynu absolutnej temperatury systemu, przez entropię systemu”::
F = u - tarcie
Jest to funkcja temperatury t i objętości v. Kroki do wizualizacji są następujące:
Może ci służyć: wewnętrzne elektrony- Począwszy od pierwszego prawa termodynamiki, energii wewnętrznej lub jest związane z entropią systemu i jego objętością V dla odwracalnych procesów poprzez następującą relację zróżnicowaną:
du = dq - dw = tds - PDV
Wynika to z tej energii wewnętrznej lub funkcji zmiennych S I V, W związku z tym:
U = u (s, v)
- Teraz definicja F I jest wyprowadzony:
df = du - d (ts) = du - tds - sdt
- Zastępowanie tam wyrażenia różnicowego uzyskane dla DU w pierwszym etapie pozostaje:
Df = TDS - PDV - TDS - SDT = -SDT - PDV
- Wreszcie stwierdzono, że F jest funkcją temperatury t i objętości V i można go wyrazić jako:
F = f (t, v)
 Rysunek 2. Hermann von Helmholtz (1821–1894), niemiecki fizyk i lekarz, uznany za swój wkład w elektromagnetyzm i termodynamikę, między innymi obszarami nauki. Źródło: Wikimedia Commons.
Rysunek 2. Hermann von Helmholtz (1821–1894), niemiecki fizyk i lekarz, uznany za swój wkład w elektromagnetyzm i termodynamikę, między innymi obszarami nauki. Źródło: Wikimedia Commons. Spontaniczne procesy
Energię Helmholtza można zastosować jako ogólne kryterium spontaniczności w izolowanych systemach, ale zanim należy określić pewne pojęcia:
- A system zamknięty Może wymieniać energię z środowiskiem, ale nie może wymieniać materii.
- Zamiast tego system izolowany nie wymienia materii ani energii ze środowiskiem.
- Wreszcie a otwarty system wymieniać materię i energię ze środowiskiem.
 Rysunek 3. Systemy termodynamiczne. Źródło: Wikimedia Commons. Fjgar (bis) [cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0)].
Rysunek 3. Systemy termodynamiczne. Źródło: Wikimedia Commons. Fjgar (bis) [cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. W procesach odwracalnych zmienność energii wewnętrznej jest obliczana w następujący sposób:
Du = TDS - PDV
Załóżmy teraz, że stały objętość (izokoryczna), w którym drugi termin poprzedniego wyrażenia ma zerowy wkład. Należy również pamiętać, że zgodnie z Nierówność Clausiusa:
ds ≥ dq/t
Taka nierówność dotyczy izolowanego układu termodynamicznego.
Tak, że dla procesu (odwracalnego lub nie), w którym objętość jest utrzymywana stała, była spełniona:
Może ci służyć: kwas fosforowy (H3PO4)T ds ≥ du (Przy stałej objętości)
Biorąc pod uwagę:
df = du - t ds
Będziemy musieli w procesie izokorycznym w stałej temperaturze, jest spełnione, że: DF ≤ 0, Jak wskazano na początku.
Tak że energia Helmholtza F jest zmniejszającą ilością spontanicznego procesu, gdy jest to izolowany system. F osiąga swoją minimalną i stabilną wartość, gdy osiągnięto odwracalną równowagę.
Rozwiązane ćwiczenia
Ćwiczenie 1
Oblicz zmianę energii swobodnej Helmholtza F dla 2 moli idealnego gazu w temperaturze 300k podczas izotermicznej ekspansji, która prowadzi do układu początkowej objętości 20 litrów do końcowej objętości 40 litrów.
Rozwiązanie
Począwszy od definicji F:
F = u - t s
Wówczas skończona zmienność F, zwana ΔF, będzie:
ΔF = δu - t δs
Jak stwierdzenie stwierdza, że temperatura jest stała: ΔT = 0. Jednak w gazach idealnych energia wewnętrzna zależy tylko od jej temperatury bezwzględnej, ale ponieważ jest to proces izotermiczny, zatem jest to proces izotermiczny Δu = 0 I ΔF = - t δs. W przypadku gazów idealnych, entropia odmiana procesu izotermicznego jest napisana w ten sposób:
ΔS = n.R.LN (v2/V1)
Zastosowanie tego wyrażenia:
ΔS = 2 mole x 8314 J/(k mol) x ln (40l/20l) = 11,53 J/k
Wreszcie zmiana energii Helmholtza wynosi:
ΔF = - t δS = - 300K x 11,53 J/k = -3457,70 j.
Ćwiczenie 2
Wewnątrz cylindra znajduje się tłok, który dzieli go na dwie sekcje i po każdej stronie tłoka są N mole idealnego monoatomowego gazu, jak pokazano na poniższym rysunku.
Ściany cylindra są dobrymi przewodnikami cieplnymi (diatermiczny) i mają kontakt z zbiornikiem temperatury Talbo.
Początkowa objętość każdej z sekcji cylindrów to v1i i v2i, podczas gdy jego ostateczne tomy to V1f i v2f Po quasiestatycznym wysiedleniu. Tłok porusza się za pomocą tłoka, który hermetycznie przecina dwa cylindryczne tapas.
Może ci służyć: Tecnecio (TC): Struktura, właściwości, użycie, uzyskiwanieJest proszony o znalezienie:
a) Zmiana energii wewnętrznej gazu i pracy wykonanej przez system i
b) Zmiana energii Helmholtza.
Rozwiązanie
Gdy tłok porusza się quasstatycznie, siła zewnętrzna przyłożona do tłoka musi zrównoważyć siłę ze względu na różnicę ciśnienia w dwóch odcinkach cylindra.
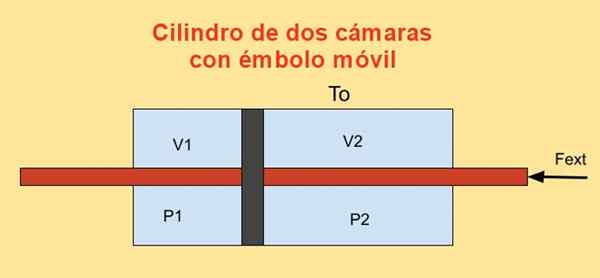 Rysunek 4. Zmienność energii swobodnej f w cylindrze z dwoma kamerami. Źródło: f. Zapata.
Rysunek 4. Zmienność energii swobodnej f w cylindrze z dwoma kamerami. Źródło: f. Zapata. Praca DW Wykonane przez siłę zewnętrzną Fext Podczas nieskończenie małego przemieszczenia Dx Jest:
Dw = - fext Dx = (p1 - P2) A dx = p1 DV1 + P2 DV2
Gdzie stosowano związek DV1 = - DV2 = DX, istnienie Do Obszar tłokowy. Z drugiej strony zmienność energii Helmholtza wynosi:
Df = -sdt - PDV
Ponieważ podczas procesu temperatura się nie zmienia, zatem DT = 0 I Df = - PDV. Zastosowanie tego wyrażenia do każdej sekcji cylindra, który masz:
dw = p1 DV1 + P2 DV2 = - df1 - Df2
Istnienie F1 I F2 Energie Helmholtza w każdej z kamer.
Skończone prace W można obliczyć na podstawie skończonej zmienności energii Helmholtza w każdej kamery:
W = -ΔF1 - ΔF2
Rozwiązanie b
Aby znaleźć zmianę energii z Helmholtza, używana jest definicja: F = u - t s. Jak w każdym kamerze masz idealny gaz monoatomowy w stałej temperaturze Talbo, Energia wewnętrzna nie zmienia się (δu = 0), więc: ΔF = - Talbo Δs. Oprócz:
ΔS = nr ln (vF/Piła)
Że przez zastąpienie go w końcu pozwala na wykonaną pracę, to:
W = -talbo Nr ln (v1f /V1i) -To nr ln (v2f /V2i) = -ΔF1 -ΔF2
W = - do nr ln [(v1f ⋅ v1i)/(V2f .V2i)] = - δfcałkowity
Istnienie ΔFcałkowity Całkowita zmienność energii Helmholtza.
Bibliografia
- Castaños e. Ćwiczenia energetyczne. Odzyskane z: lidiaconlachimica.WordPress.com
- Librettexts. Helmholtz Energy. Odzyskane z: chem.Librettexts.org
- Librettexts. Co to jest bezpłatna energia. Odzyskane z: chem.Librettexts.org
- Wikipedia. Helmholtz Energy. Odzyskane z: jest.Wikipedia.com
- Wikipedia. Helmholtz Free Energy. Źródło: w:.Wikipedia.com

