Elektronialiczność
- 4198
- 1159
- Herbert Wróblewski
Co to jest elektroonywatywność?
Elektronialiczność Jest to względna właściwość okresowa, która dotyczy zdolności atomu przyciągania gęstości elektronicznej środowiska molekularnego. To jest trend atomu, który przyciąga do siebie elektrony, gdy jest on przymocowany do cząsteczki. Znajduje to odzwierciedlenie w zachowaniu wielu związków i tym, jak międzycząsteczowo oddziałują ze sobą.
Innymi słowy, im bardziej elektroongenacja jest atomem, tym większa zdolność do przyciągania elektronów innych atomów; Będzie również miał wyższy potencjał jonizacji, co pozwala utrzymać elektrony w obliczu zewnętrznego przyciągania, przyciągając elektrony otaczających atomów.
Teraz nie wszystkie elementy przyciągają w tym samym stopniu elektrony sąsiednich atomów. W przypadku tych, którzy dają gęstość elektroniczną, mówi się, że są elektrododatni, Podczas gdy są ci, którzy „pokrywają” elektrony Elektonegiety. Istnieje wiele sposobów wyjaśnienia i obserwowania tej właściwości (lub koncepcji).
Na przykład na mapach potencjałów elektrostatycznych dla cząsteczki (takich jak dwutlenek chloru na obrazie, Clo2) Obserwuje się wpływ różnych elektroungeliczności dla atomów chloru i tlenu.
Czerwony kolor wskazuje regiony bogate w elektrony cząsteczki, δ- i niebieski kolor, który jest słaby w elektronach, δ+. Zatem po serii obliczeń obliczeniowych można ustalić ten rodzaj map; Wiele z nich wykazuje bezpośredni związek między lokalizacją atomów elektroungatywnych a δ-.
Można go również wizualizować w następujący sposób: W cząsteczce bardziej prawdopodobne jest, że tranzyt elektronów wystąpił w pobliżu najbardziej elektrononegatywnych atomów.
Z tego powodu dla Clo2 Atomy tlenu (czerwone kule) są otoczone czerwoną chmurą, podczas gdy atom chloru (zielona kula) niebieskawo -chmur.
Definicja elektroonywatywności zależy od podejścia do tego zjawiska, istnieje kilka skal, które uwzględniają to z różnych aspektów. Jednak wszystkie skale mają wspólnego, że są one poparte wewnętrzną naturą atomów.
Skale elektroonegatywności
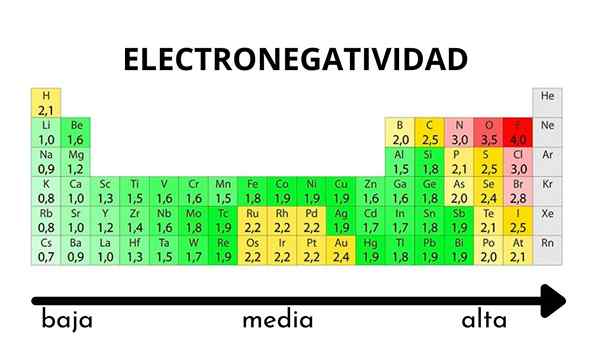
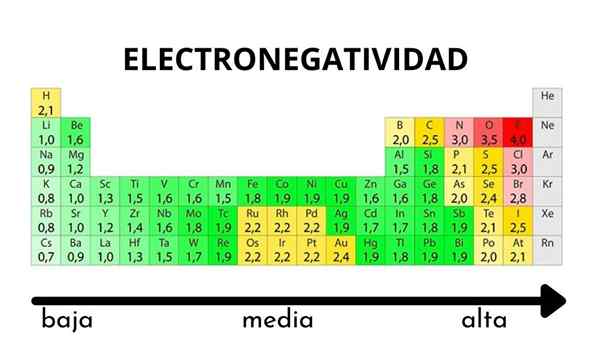 W tabeli okresowej można zaobserwować, gdy wartość elektroonywatywności wzrasta lub zmniejsza
W tabeli okresowej można zaobserwować, gdy wartość elektroonywatywności wzrasta lub zmniejsza Elektroniarzowość nie jest właściwością, którą można określić ilościowo, ani nie ma wartości bezwzględnych. Jest tak, ponieważ trend atomu przyciągania do niego gęstości elektronicznej nie jest taki sam we wszystkich związkach. Innymi słowy: elektroonegatywność różni się w zależności od cząsteczki.
Jeśli dla cząsteczki CLO2 Atom CL zostanie zmieniony na N, wówczas tendencja lub przyciągania elektronów również zostanie zmodyfikowana; Można go zwiększyć (uzyskać chmurę Redst) lub zmniejszyć (stracić kolor). Różnica leżyłaby w utworzonym nowym połączeniu N-O, aby mieć cząsteczkę O-N-O (dwutlenek azotu, NO2).
Może ci służyć: związek chemii i technologii z istotami ludzkimi, zdrowiem i środowiskiemPonieważ elektroonywność atomu nie jest taka sama dla wszystkich jego środowisk molekularnych, konieczne jest zdefiniowanie go zgodnie z innymi zmiennymi. W ten sposób istnieją wartości, które służą jako odniesienie i umożliwiające przewidywanie, na przykład rodzaj uformowanego łącza (jonowego lub kowalencyjnego).
Skala Pauling
Wielki naukowiec i zwycięzca dwóch nagród Nobla, Linus Pauling (1901–1994), podniesiony w 1932 r. Ilościową (mierzalną) formę elektroonegatywności, znaną jako Pauling Scale Scale. W nim elektroonegatywność dwóch elementów, A i B, tworzących linki, była związana z dodatkową energią związaną z charakterem jonowym łącza A-B.
Teoretycznie wiązania kowalencyjne są najbardziej stabilne, ponieważ rozkład ich elektronów między dwoma atomami jest sprawiedliwy; to znaczy dla cząsteczek A-A i B-B oba atomy dzielą elektrony wiązania w ten sam sposób. Jeśli jednak a jest bardziej elektroonywalny, to wspomniana para będzie więcej niż B.
W takim przypadku A-B nie jest już całkowicie kowalencyjne, chociaż jeśli jego elektrooniczność nie różnią. Kiedy tak się dzieje, ogniwo ulega niewielkiej niestabilności i nabiera dodatkowej energii jako produkt różnicy elektroungatyczności między A i B.
Im większa ta różnica to, tym bardziej energia łącza A-B, a tym samym, tym większy charakter jonowy wspomnianego linku.
Ta skala reprezentuje najczęściej stosowane w chemii, a wartości elektroungatoryczności wyłoniły się z przydziału wartości 4 dla atomu fluoru (element o najniższej elektroungalizacji to cesium, z 0,7). Stamtąd mogliby obliczyć to z innych elementów.
Skala Mulliken
Podczas gdy skala Paulinga ma związek z energią związaną z linkami, Skala Roberta Mulliken (1896–1986) jest bardziej powiązana z dwoma innymi właściwościami okresowymi: energia jonizacji (EI) i powinowactwo elektroniczne (AE).
Zatem element o wysokich wartościach EI i AE jest bardzo elektroonywalny, a zatem przyciąga elektrony z jego środowiska molekularnego.
Ponieważ? Ponieważ odzwierciedla to, jak trudno jest „uruchomić” elektron zewnętrzny i jak stabilny anion utworzony w fazie gazowej jest tak stabilny. Jeśli obie właściwości mają duże wielkości, wówczas elementem jest „kochanek” elektronów.
Może ci służyć: fusionMulliken Electonegativities są obliczane z następującym wzorem:
ΧM = ½ (EI + AE)
To znaczy, χM Jest równy średniej wartości EI i AE.
Jednak w przeciwieństwie do skali Paulinga, która zależy od tego, jakie połączenia tworzą atomy, jest to związane z właściwościami stanu Walencji (z jej najbardziej stabilnymi konfiguracją elektroniczną).
Obie skale generują podobne wartości elektroonegatywności dla pierwiastków i odnoszą się w przybliżeniu do następującej konwersji:
ΧP = 1.35 (χM)1/2 - 1.37
Oba xM jako xP Są to wartości bezwymiarowe; Oznacza to, że brakuje im jednostek.
Skala a.L. Allred i e. Rochow
Istnieją inne skale elektroonegatywności, takie jak Sanderson i Allen. Jednak ten, który podąża za pierwszymi dwoma, to skala Allred i Rochow (χAr). Ta skala opiera się na skutecznym obciążeniu jądrowym, jakiego elektron doświadcza na powierzchni atomów. Dlatego jest bezpośrednio związany z atrakcyjną siłą jądra i efektem ekranu.
Jak różni się elektroonigatywność w stole okresowym?
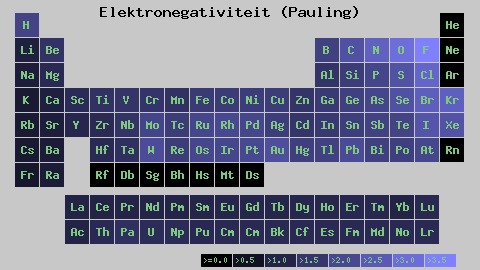 Pauling Electronegativity Scale. Źródło: Wikimedia Commons
Pauling Electronegativity Scale. Źródło: Wikimedia Commons Niezależnie od skal lub wartości, które ma, elektroonegatywność wzrasta od prawej do lewej przez okres i od dołu w grupach. Zatem wzrasta w kierunku prawej górnej przekątnej (nie licząc helu), dopóki fluor będzie.
Na lepszym obrazie, świeżo powiedziane. W stole okresowym Pauling Electronetronegativities wyraża się zgodnie z kolorami pudełek. Ponieważ fluor jest najbardziej elektroonywalny, zależy od bardziej szorstkiego fioletowego koloru, podczas gdy mniej elektroongeneracyjne (lub elektropozytywne) kolory.
Można również zauważyć, że grupy głowy (h, be, b, c itp.) Mają najczystsze kolory, a gdy grupa jest zstąpiona przez inne elementy. O czym to jest? Odpowiedź jest ponownie we właściwościach EI, AE, ZEF (efektywne obciążenie jądrowe) i na promieniu atomowym.
Atom w cząsteczce
Poszczególne atomy mają rzeczywiste elektrony jądrowe, a zewnętrzne elektrony cierpią na skuteczny produkt obciążenia jądrowego efektu ekranowania.
Gdy porusza się przez pewien czas, ZEF wzrasta w taki sposób, że atom jest skurczony; Oznacza to, że radiotelefonu atomowe są zmniejszone przez cały okres.
Powoduje to, że w momencie łączenia jednego atomu z drugim elektrony „przepłyną” do atomu z większym ZEF. Daje to również link charakter jonowy, jeśli istnieje wyraźny trend elektronów, aby przejść do atomu. Kiedy nie, mówi się o głównie kowalencyjnej więzi.
Może ci służyć: fioletowe szkłoZ tego powodu elektroonywność zmienia się w zależności od radiotelefonów atomowych, ZEF, które z kolei są ściśle powiązane z EI i AE. Wszystko jest łańcuchem.
Przydatność elektroony
Elektroronialiczność służy zasadniczo w celu ustalenia, czy związek binarny jest kowalencyjny czy jonowy. Gdy różnica elektroungatyczności jest bardzo wysoka (z prędkością 1.7 jednostek lub więcej) Mówi się, że związek jest jonowy.
Przydatne jest również rozpoznanie w strukturze, które regiony będą bogatsze w elektronach.
Stąd można przewidzieć, który mechanizm lub reakcja może ponieść związek. W biednych regionach elektronów δ+możliwe jest, że ujemnie naładowane gatunki uzyskane w określony sposób; A w regionach bogatych w elektronach ich atomy mogą oddziaływać w bardzo specyficzny sposób z innymi cząsteczkami (interakcje dipol-dipolo).
Przykłady (chlor, tlen, sód, fluork)
Jakie są wartości elektronegatywności dla atomów chloru, tlenu, sodu i fluoru? Po fluorku, który jest najbardziej elektroonywalny? Używając okresu okresowego, obserwuje się, że sód ma ciemny fioletowy kolor, podczas gdy kolory tlenu i chlor są wizualnie bardzo podobne.
Ich wartości elektroungatystycznych dla skal Paulinga, Mulliken i Allred-rhow są:
Na (0.93, 1.21, 1.01).
Lub (3.44, 3.22, 3.pięćdziesiąt).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Zauważ, że przy wartościach liczbowych istnieje różnica między negatywnością tlenu i chloru.
Zgodnie ze skalą Mulliken chlor jest bardziej elektroongeneracyjny niż tlen, w przeciwieństwie do skal Paulinga i Allred-Rhochow. Różnica w elektroonywatywności między obiema pierwiastkami jest jeszcze bardziej widoczna przy użyciu skali Allred-row. I wreszcie fluor, niezależnie od wybranej skali, jest najbardziej elektroonywalny.
Dlatego tam, gdzie jest atom F w cząsteczce, oznacza, że łącze będzie miało wysoki charakter jonowy.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja., P. 30 i 44). MC Graw Hill.
- Jim Clark. (2000). Elektonegiczność. Zaczerpnięte z: chemguide.współ.Wielka Brytania
- Anne Marie Helmestine, pH.D. (11 grudnia 2017 r.). Definicja i przykład elektroony i przykład. Zaczerpnięte z: Thoughtco.com
- Mark e. Tuckerman. (5 listopada 2011). Skala elektroungatity. Zaczerpnięte z: NYU.Edu
- Wikipedia (2018). Elektronialiczność. Zaczerpnięte: to jest.Wikipedia.org

