Struktura dwutlenku chloru (CLO2) wykorzystuje, uzyskiwanie, ryzyko, właściwości

- 4596
- 1268
- Gabriela Łuczak
On Dwutlenek chloru Jest to związek nieorganiczny utworzony przez element chloru (CL) i tlen (O). Jego formuła chemiczna to Clo2. To zielonkawy do czerwonawego żółtego gazu. Nie jest to naturalnie znalezione w środowisku.
Jest wyjątkowo reaktywny, więc często jest przygotowywany w miejscu, w którym będzie używane. Jednym z jego najważniejszych zastosowań jest mikrobobójstwo, antyseptyczne i dezodoryzacja, ponieważ bardzo łatwo eliminuje bakterie, wirusy i grzyby.
 Niektóre żywność sprzedawane w supermarketach mogły zostać zdezynfekowane dwutlenkiem chloru CLO2. Autor: ElasticComputeFarm. Źródło: Pixabay.
Niektóre żywność sprzedawane w supermarketach mogły zostać zdezynfekowane dwutlenkiem chloru CLO2. Autor: ElasticComputeFarm. Źródło: Pixabay. Pozwala dezynfekować pokarmy, takie jak warzywa, owoce, mięso, ptaki i owoce morza. Służy do higieny powierzchni, podłóg, łazienek, systemów wentylacji, basenów, sprzętu laboratoryjnego, sprzętu dentystycznego itp.
Dlatego jest stosowany w przetwarzaniu żywności, w szpitalach i klinikach, w branżach i sklepach. Służy do oczyszczania wody używanej do picia, a także ścieków miejskich.
Jest bardzo skuteczny jako środek utleniający, więc służy między innymi do wybielania papierowej miazgi, olejków, mąki, skóry, włókien tekstylnych.
Kiedy jest w postaci gazu, jest bardzo niebezpieczny, ponieważ jest bardzo wybuchowy i jest stosowany głównie w roztworach wodnych. Jest toksyczny, jeśli jest wdychany.
[TOC]
Struktura
Dwutlenek chloru powstaje przez połączenie atomu chloru (CL) z dwoma atomami tlenu (O). Połączenia chloru z każdym tlenem są kowalencyjne i podwójne. Chlor w tym związku ma wartościowość +4.
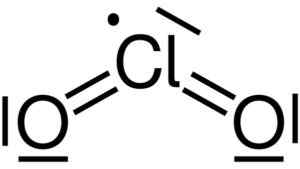 Struktura Lewisa dwutlenku chloru2. Yikrazuul [domena publiczna]. Źródło: Wikimedia Commons.
Struktura Lewisa dwutlenku chloru2. Yikrazuul [domena publiczna]. Źródło: Wikimedia Commons. Ma symetryczną i kątową konstrukcję w kształcie kątów, ponieważ ma wolne elektron. To znaczy nie tworzą linku z żadnym innym atomem.
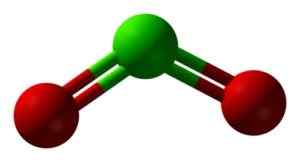 Struktura CLO2 w trzech wymiarach. Zielony = chlor; Czerwony = tlen. Ben Mills i Jynto [domena publiczna]. Źródło: Wikimedia Commons.
Struktura CLO2 w trzech wymiarach. Zielony = chlor; Czerwony = tlen. Ben Mills i Jynto [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
- Dwutlenek chloru
- Tlenek chloru (IV)
Nieruchomości
Stan fizyczny
Zielonkawo -żółty do czerwonawego żółtego gazu.
Waga molekularna
67,45 g/mol.
Temperatura topnienia
-59 ° C.
Punkt wrzenia
11 ° C.
Gęstość
Ciecz w 0 ° C = 1642 g/cm3
Gaz = 2,33 (gęstość względna powietrza, powietrze = 1).
Może ci służyć: alkohol izoamylowy: struktura, właściwości, zastosowania i ryzykoRozpuszczalność
Rozpuszczalna w wodzie: 2000 cm3 Clo2 Gaz przy 100 cm3 zimnej wody lub 0,8 g/100 ml wody w 20 ° C. Rozpuszczalne w roztworze alkalicznym i roztworze kwasu siarkowego H2południowy zachód4.
Właściwości chemiczne
CLO2 Jest wyjątkowo reaktywny i może gwałtownie wykorzystać. Jest to bardzo skuteczny środek utleniający.
CLO2 Łamie się gwałtownie, jeśli ma kontakt z materiałami organicznymi. Jeśli jesteś w powietrzu w stężeniu większym niż 10%, może eksplodować z powodu światła słonecznego lub ciepła.
Możesz także detonować w obecności rtęci (HG) lub tlenku węgla (CO).
Pod działaniem ultrafioletu (UV) lub ozonu CLO2 Staje się chlorkiem2ALBO6, bardzo niestabilny związek.
Właściwości twoich wodnych roztworów
Jego wodne roztwory to żółte lub czerwonawo żółte. Są stabilne, jeśli pozostają zimne, dobrze zapieczętowane i chronione przed światłem słonecznym. W obecności światła roztwory te są powoli rozkładane, aby dać kwas hydrochlorowy HCl i kwas chlorowy HCLO3.
 Roztwór wodny Clo2 gdzie obserwuje się, że uwalnia się żółty gaz, czyli CLO2. Autor: MaterialScientist. Źródło: Wikimedia Commons.
Roztwór wodny Clo2 gdzie obserwuje się, że uwalnia się żółty gaz, czyli CLO2. Autor: MaterialScientist. Źródło: Wikimedia Commons. W roztworach alkalicznych CLO2 Jest podzielony na jony chlorynowe2- i Clorate3-. W roztworach kwasowych kwas chlorowy tworzy HCLO2 a następnie jest to rozkładane na kwas hydrochlorowy HCl i kwas chlorowy HCLO3.
Inne właściwości
Skoncentrowane pary CLO2 Są potencjalnie wybuchowe, więc nie było możliwe kompresowanie. Z tego powodu preferowane jest przygotowanie go na miejscu, w którym będzie używany.
Kiedy jest to bardzo niskie temperatury w swoim uwodnionym kształcie, w ten sposób jest czasem przenoszony, jest stałą w postaci bloku podobnego do lodu i pomarańczowego.
Ma zapach podobny do chloru. Jest toksyczny przez wdychanie.
Uzyskanie
Można uzyskać na kilka sposobów. Na przykład w niektórych przypadkach rozwiązania CLO2 Przygotowują się do przejścia mieszanki gazu chloru (Cl2) oraz powietrze (lub gaz chloru i azotu2) przez kolumnę zawierającą granulki chlorynowe sodu (naclo2).
Może ci służyć: warstwa Valencia2 Naclo2 + Cl2 → 2 NaCl + 2 CLO2
Wygenerowany produkt zawiera około 90% CLO2, Wśród innych związków chloru.
Jest również uzyskiwany z chloranu potasu (kclo3) i kwas siarkowy (h2południowy zachód4) W obecności kwasu szczawiowego jako reduktora. W takim przypadku powstaje również dwutlenek węgla (CO2) To służy do rozcieńczenia CLO2.
Można go przygotować na miejscu użycia na podstawie chloranu sodu (NaClo3), kwas siarkowy (h2południowy zachód4) i metanol (wybierz3OH).
W branży jest uzyskiwana przez chloran sodu (Naclo3) i dwutlenek siarki (więc2) W obecności kwasu siarkowego.
2 Naclo3 + południowy zachód2 + H2południowy zachód4 → 2 Clo2 + 2 Nahso4
Używa się jako środki dezynfekujące
Może być stosowany jako potężny środek przeciwdrobnoustrojowy. Stwierdzono, że jest bardzo skuteczny przeciwko kilku mikroorganizmom, takimi jak Escherichia coli i Staphylococcus aureus.
Z tym ostatnim, stężenie tylko 5 ppm Clo2 wyeliminować 100% z nich. Jest bakteriobójczy, antyseptyczny i dezodoryzujący. Jest skuteczny w szerokim odstępie pH.
W jedzeniu
Jest stosowany jako środek przeciwdrobnoustrojowy w wodzie do fumigacji owoców i warzyw, w przetwarzaniu ptaków ptaków, czerwonych mięs, obu kawałków mięsa i narządów oraz produktów morskich i owoców morza.
 Czerwone mięso supermarketów mogło być traktowane dwutlenkiem chloru, aby je dezynfekować. Autor: Karamo. Źródło: Pixabay.
Czerwone mięso supermarketów mogło być traktowane dwutlenkiem chloru, aby je dezynfekować. Autor: Karamo. Źródło: Pixabay. Roztwory dwutlenku chloru powinny być stosowane w stężeniu, które nie przekracza 3 ppm (strony na milion) CLO2 resztki, aby nie miało wpływu na jedzenie.
Po leczeniu CLO2 Wszystkie pokarmy muszą być całkowicie rządzone wodą pitną lub powinna być używana jako oparzenie, gotowanie lub puszki.
W przypadku produktów morskich roztwór kanalizacyjny2 Powinien być używany w wodzie i lodzie, które są używane w płukaniu, mycie, rozmrażaniu, transporcie lub magazynowaniu. Surowe owoce morza należy następnie bardzo dobrze umyć wodą pitną przed zużyciem.
 Zimna woda i lód, z którymi owoce morskie zawierają niewielkie ilości Clo2. Autor: Public DomeAnpartures. Źródło: Pixabay.
Zimna woda i lód, z którymi owoce morskie zawierają niewielkie ilości Clo2. Autor: Public DomeAnpartures. Źródło: Pixabay. Na papierze i tekturze, które będą w stanie zetknąć się z jedzeniem
Rozwiązania CLO2 Służą one do eliminowania mikroorganizmów, które powodują szczupłe (takie jak glony, bakterie i grzyby) w procesie woda stosowana w produkcji papieru i tektury, które będą w stanie zetknąć się z żywnością.
Może ci służyć: cząsteczki apolarneW wodzie pitnej
Służy do oczyszczania wody i sprawia, że jest pitna (bezpiecznie do picia). Jest stosowany w wstępnej obróbce wody, która następnie zostanie butelkowana do picia lub wody, która będzie używana jako składnik produkcji napojów lub napojów bezalkoholowych.
 Niektóre przetworzone napoje bezalkoholowe mogą zawierać oczyszczoną wodę z CLO2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Niektóre przetworzone napoje bezalkoholowe mogą zawierać oczyszczoną wodę z CLO2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. W stomatologii
Jest stosowany w instrumentach używanych przez dentystę lub dentystę do ich dezynfekcji i zniszczenia organizmów patogenów.
W zastosowaniach medycznych
Wodne roztwory CLO2 Były one stosowane w leczeniu kandydozy jamy ustnej (infekcja jamy ustnej). Kandydoza to infekcja grzyba Candida albicans.
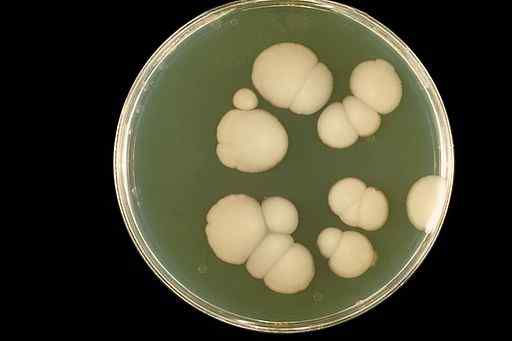 Wygląd grzyba Candida albicans w uprawie laboratoryjnej. CDC/DR. William Kaplan [domena publiczna]. Źródło: Wikimedia Commons.
Wygląd grzyba Candida albicans w uprawie laboratoryjnej. CDC/DR. William Kaplan [domena publiczna]. Źródło: Wikimedia Commons. Dwutlenek chloru eliminuje usta z jamy ustnej i znacznie poprawia wygląd tkanek doustnych bez skutków ubocznych.
Niektórzy badacze medyczne wskazują, że CLO Solutions2 Zastosowane do ran operacyjnych chirurgicznych, mogą one zmniejszyć lub tłumić tworzenie się przystąpień bez wpływu na leczenie tego samego, z dodatkową zaletą jego właściwości antyseptycznych.
Inne zastosowania
Ze względu na jego właściwości utleniające i drobnoustrojowe CLO2 jest używany do:
- Wybielają celulozę drewna w produkcji miazgi i papieru, zapewniając stabilny połysk.
- Udekoruj tłuszcze i oleje, skórę, mąkę i tkaniny wybielne.
- Zastosowania rolnicze, takie jak dezynfekcja twardych powierzchni, sprzęt, systemy wodne i szklarnie grzybowe.
- Zastosowania w branżach, sklepach i szpitalach, takich jak dezynfekcja twardych powierzchni (ściany, podłogi, łazienki), systemy wentylacyjne, sprzęt laboratoryjny.
- Dezynfekujące mieszkania i łazienki gospodarstw domowych, systemy klimatyzacji, systemy krążenia wody pływackiej.
- Oczyszczanie ścieków miejskich i przemysłowych.
- Czyszczenie zanieczyszczenia pól olejowych.
- Produkcja soli chlorkowych (CL-).
Ryzyko
- Skoncentrowane pary CLO2 Są potencjalnie wybuchowe.
- Jest toksyczny przez wdychanie i spożycie. Jest to drażniące oko, nos i gardło, może powodować obrzęk płuc i przewlekłe zapalenie oskrzeli.
- Według źródeł konsultacji z CLO2 nie powoduje mutacji DNA ani nie powoduje raka u ludzi.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Dwutlenek chloru. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Dean, J.DO. (redaktor). (1973). Lange's Handbook of Chemistry (Eleventh Edition). McGraw-Hill Book Company.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. VCH Verlagsgellschaft MBH.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Bajpai, s. 1. (2012). Bielenie dwutlenku chloru. Wpływ wybielania dwutlenku chloru na jakość pulpy. W łagodnym środowisku podejście do wybielania miazgi (wydanie drugie). Odzyskane z naukowym.com.
- Moran, s. (2018). Chemia wody. Dwutlenek chloru. W zastosowanym przewodniku po projekcie oczyszczalni wody i ścieków. Odzyskane z naukowym.com.
- McKen, L. (2012). Wprowadzenie do żywności i sterylizacji medycznej. Gazowy diesek klokrętny. W przypadku sterylizacji na tworzywa sztuczne i elastomery (wydanie trzecie). Odzyskane z naukowym.com.
- « Górne cechy paleolityczne, sztuka, organizacja społeczna
- Struktura kwasu sulfonowego, nomenklatura, właściwości, zastosowania »

