Struktura kwasu sulfonowego, nomenklatura, właściwości, zastosowania
- 2052
- 233
- Eliasz Dubiel
Nazywa się Kwas sulfonowy W ogóle związek należący do rodziny kwasów organicznych, które mają jedną lub więcej grup -3H. Niektórzy autorzy wskazują, że związek ojca to H-S (= O)2-Aha, lub H-So3H, nazywane przez jakiś „kwas sulfonowy”, jednak jego istnienie nie zostało udowodnione, ani nie istniała jego tautomer HO -S (= O) -OH znany jako „kwas siarkowy” (H H2południowy zachód3), ani w roztworze, ani w stanie stały.
Ten ostatni jest tym, że gaz dwutlenku siarki (IV) (więc2) W roztworze wodnym staje się jonami Bisulfit (HSO3-) i pirozulfit (s2ALBO52-) I nie do H-S (= O)2-OH lub HO -S (= O) -OH, który został już udowodniony przez wielu badaczy chemicznych.
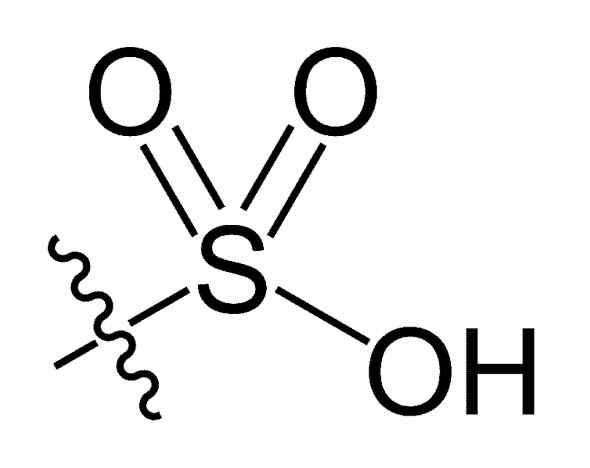
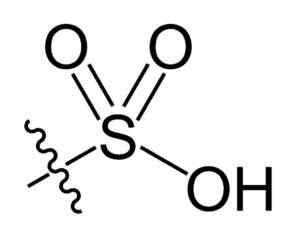 Grupa sulfonilowa. Choij [domena publiczna]. Źródło: Wikipedia Commons
Grupa sulfonilowa. Choij [domena publiczna]. Źródło: Wikipedia Commons W wzorze chemicznym R-TA3H kwasów sulfonowych, grupa R może reprezentować szkielety węglowodorowe, takie jak alkan, alliqueno, alchen i/lub piasek. Mogą one zawierać wtórne funkcje, takie jak ester, eter, keton, amino, amido, hydroksyl, karboksyl i fenol, między innymi.
Kwasy sulfonowe są silnymi kwasami, porównywalnymi z kwasem siarkowym (H (H2południowy zachód4). Jednak reszta jego nieruchomości zależy w dużej mierze od charakteru grupy r.
Niektóre mają tendencję do dezulfonaru w wysokich temperaturach. Oznacza to utratę grupy -3H, zwłaszcza gdy r jest piaszczyste, to znaczy z pierścieniem benzenowym.
Kwasy sulfonowe mają wiele zastosowań w zależności od wzoru chemicznego. Służą one do produkcji barwników, atramentów, polimerów, detergentów, środków powierzchniowo czynnych i jako katalizatorów, wśród wielu innych zastosowań.
[TOC]
Struktura
Kwasy sulfonowe mają następującą ogólną strukturę:
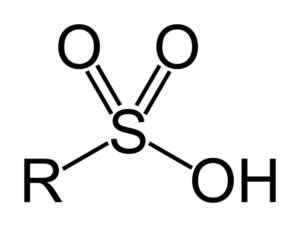 Ogólny wzór kwasów sulfonowych. Benjah-BMM27 [domena publiczna]. Źródło: Wikipedia Commons
Ogólny wzór kwasów sulfonowych. Benjah-BMM27 [domena publiczna]. Źródło: Wikipedia Commons Nomenklatura
- Grupa sulfonilowa: -So3H
- Wynajem lub kwas arilsulfonowy: R-TO3H
Nieruchomości
Są one stałe lub cieczowe w zależności od grupy r. Żadne gazowe kwasy sulfonowe nie są znane.
Jego właściwości fizyczne i chemiczne zależą od charakteru grupy r. W porównaniu, istnieją pewne właściwości fizyczne kilku kwasów sulfonowych, gdzie p.F. To jest punkt topnienia i p.I. Jest to temperatura wrzenia pod ciśnieniem 1 mm Hg:
- Kwas metanosulfonowy: P.F. 20 ° C; P.I. 122 ° C
- Kwas etanosofonowy: P.F. -17 ° C; P.I. 123 ° C
- Kwas proposulfonowy: P.F. -37 ° C; P.I. 159 ° C
- Kwas butanosulfonowy: P.F. -15 ° C; P.I. 149 ° C
Może ci służyć: chlorek żelazny (FECL2): struktura, zastosowania, właściwości- Kwas pentosulfonowy: P.F. -16 ° C; P.I. 163 ° C
- Kwas szesnosulfonowy: P.F. 16 ° C; P.I. 174 ° C
- Kwas benzefoniczny: P.F. 44 ° C; P.I. 172 ° C (przy 0,1 mm Hg)
- Kwas p-toluensulfonowy: P.F. 106 ° C; P.I. 182 ° C (przy 0,1 mm Hg)
- 1 kwas naftalensulnowy: P.F. 78 ° C; P.I. Rozkłada się
- 2-naftalensulfonowy kwas: P.F. 91 ° C; P.I. Rozkłada się
- Kwas trifluorometanosulfonowy: P.F. nic; P.I. 162 ° C (przy 760 mm Hg)
Większość jest bardzo rozpuszczalna w wodzie.
Kwasy sulfonowe to jeszcze więcej kwasów niż kwasy karboksylowe. Mają kwasowość podobną do kwasu siarkowego. Rozpuszczają się w wodnym wodorotlenku sodu i wodnym wodorowęglanowi.
Mają tendencję do rozkładu termicznego, występując w ich odejściu. Jednak kilka kwasów alkosulfonowych jest stabilnych termicznie. W szczególności kwas trójdroczny lub kwas trifluorometanosulfonowy jest jednym z najsilniejszych i najbardziej stabilnych kwasów.
Uzyskanie
Kwasy arilsulfonowe
Kwasy ailsulfonowe są ogólnie uzyskiwane w procesie sulfonowania, który polegał na dodaniu nadmiaru kwasu siarkowego (H (h2południowy zachód4 + południowy zachód3) Do związku organicznego chcemy sulfonaru. Na przykład w przypadku benzenu:
C6H6 + H2południowy zachód4 C6H5południowy zachód3H + H2ALBO
ARH + H2południowy zachód4 Arso3H + H2ALBO
Sulfonowanie jest odwracalną reakcją, ponieważ jeśli dodamy do kwasu benzeulfonu, rozcieńczony kwas i przechodzimy parę na mieszankę3 A benzen jest destylowany przez ulatnianie się z parą, wypierając równowagę w kierunku odsiarczania.
Środkiem sulfonantowym może być również kwas chlorosulfurowy, kwas sulfamowy lub sulfitowy.
Kwasy alkilofoniczne
Są one ogólnie przygotowywane przez sulfo-utlenianie, to znaczy leczenie związków alkilowych dwutlenkiem siarki2 i tlen lub2, lub bezpośrednio z trójtlekiem siarki, więc3.
RH + 2SO2 + ALBO2 + H2Lub R-SO3H + H2południowy zachód4
Aplikacje
Kwasy sulfonowe dla środków powierzchniowo czynnych i detergentów
Kwasy alcybenficzne są stosowane w produkcji detergentów, co jest jednym z najbardziej rozpowszechnionych zastosowań.
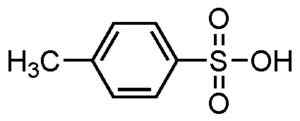 Kwas p-metylobenzefoniczny. Su-no-g. Źródło = samodzielnie. *Data = 21 sierpnia 2006. *Wykonane z Chemdraw. Źródło: Wikipedia Commons.
Kwas p-metylobenzefoniczny. Su-no-g. Źródło = samodzielnie. *Data = 21 sierpnia 2006. *Wykonane z Chemdraw. Źródło: Wikipedia Commons. Są używane do detergentów sproszkowanych i płynnych, detergentów do ciężkich lub lekkich zadań, dłoni i mydełek szamponu.
Aktywne składniki to na ogół alkebenzen liniowe i sulfonowane tłuszczowe.
Ponieważ środki powierzchniowo czynne są powszechnymi sulfonianami alfa-olefiny, sulfobetyny, sulfosukcynaty i wynajmowanymi disulfonianami disiulfonatami, z których wszystkie pochodzą z kwasów sulfonowych.
Może ci służyć: szczawian sodu (Na2C2O4): struktura, właściwości, zastosowania, ryzykoTe środki powierzchniowo czynne znajdują zastosowanie w produktach czyszczących domowych, kosmetyków, polimeryzacji w emulsjach i produkcji chemicznej dla rolnictwa.
Ligosulfoniany pochodzą z ligniny, składnika drewna i są stosowane jako dyspergowanie, nawilżanie, środki wiążące w chodnikach drogowych, dodatki betonowe i dodatki w żywności zwierzęcych.
W celu zwiększenia płynności i siły cementu stosuje się 2-naftalanosulfonowy.
Kolorystyka oparta na kwasie sulfonowym
Ogólnie charakteryzują się zawierającymi grupy AZO (R-N = N-R).
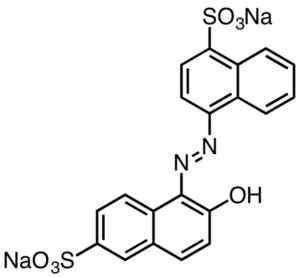 Kwasowy czerwony kolorystyka. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons.
Kwasowy czerwony kolorystyka. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons. Barwniki pochodzące z kwasu sulfonowego mają użyteczność w branży papierowej, atramenty, takie jak drukowanie wtrysku, tekstylia, takie jak bawełna i wełna, kosmetyki, mydła, detergenty, żywność i skóra.
Pochodna kwasu 2-naftalanosulfonowego jest również stosowana jako składnik kolorowania włókien poliestrowych i opalania skórzanego.
Amidy oparte na kwasach sulfonowych
Ta aplikacja podkreśla kwasy akryloamidfonowe, które mają zastosowanie polimerów, w elektrodzie metalowej, takich jak środki powierzchniowo czynne i przezroczyste powłoki antykompanitowe.
Są one również stosowane w poprawie odzyskiwania oleju, jako środki liberujące złożone na glebie, w mieszaninach cementowych hydraulicznych i jako akceleratory leczenia żywic aminoplastycznych.
Niektóre sulfonamidy są również stosowane w formułach owadobójczych.
Fluorowane i chlorofluorowe kwasy sulfonowe
Ta grupa podkreśla kwas trifluorometanosulfonowy (CF3południowy zachód3H), zwane także kwasem trójfalowym. Ten związek ma kataliza organicznej syntezy i reakcji polimeryzacji.
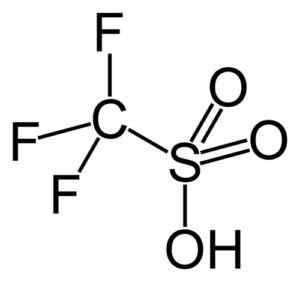 Kwas trójfalowy. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons.
Kwas trójfalowy. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons. Na przykład jest stosowany w polimeryzacji aromatycznych olefin i w przygotowaniu wysoce rozgałęzionych węglowodorów parafinowych o wysokiej liczbie oktanowej, aby wykorzystać je jako dodatki paliwa.
Innym z jego zastosowań jest synteza przewodzących polimerów, za pomocą domieszkowania poliacetylenu, wytwarzając na przykład półprzewodniki typu P.
Kwas pentafluoroetanosulfonowy (CF3Por2południowy zachód3H), znane jako kwas pentapliczny, jest stosowany jako katalizator organiczny.
Kwasy trójfalowe reaguje z pentafluorkiem antymonu (SBF5) Generowanie SO -Called „Magic Acid”, super -kwasowy katalizator, który służy do alkilacji i polimeryzacji.
Może ci służyć: nalewka jodowa: właściwości, zastosowania, przeciwwskazaniaNafion-H jest żywicą wymiany jonowej perfumowanego kwasu polimerowego. Ma charakterystykę bezwładności w kierunku silnych kwasów, silnych zasad i zmniejszenia lub utleniania.
W zastosowaniach biologicznych
Jednym z niewielu kwasów sulfonowych występujących w naturze jest kwas 2-aminoetanosulfonowy, lepiej znany jako Bull Gighting, zasadniczo aminokwas, szczególnie dla kotów.
Syntetyczne i naturalne walki byków są stosowane jako suplementy w produktach dla zwierząt domowych i farmaceutycznych.
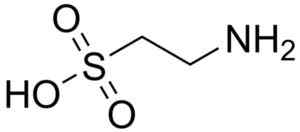 Cząsteczka walki byków. Harbinary. Źródło: Wikipedia Commons
Cząsteczka walki byków. Harbinary. Źródło: Wikipedia Commons Kwas taurokolowy jest składnikiem żółciowym i uczestniczy w trawieniu tłuszczów. 8-anielio-1-naftalanosulfonowy, związek syntetyczny, stosuje się w badaniu białek.
Kopolimery mocznika i kwas dwufenildysulfonowy zastosowano jako inhibitory wirusa opryszczki pospolitej.
Niektóre pochodne kwasu sulfonowego, takie jak sulfonowany polistyren i niektóre azokompestos, wykazały właściwości hamowania ludzkiego niedoboru odporności lub wirusa HIV, bez nadmiernego toksycznego przeciwko komórkom gospodarza.
W przemyśle naftowym
Niektóre mieszanki pochodnych oleju, które obejmują zróżnicowaną kombinację aromatycznych, parafinów i aromatycznych polinjądrowych, mogą być sulfonowane, a następnie odpowiednio zneutralizowane wytwarzanie sulfonianów olejowych SO -Calone.
Te sulfoniany olejowe mają właściwość obniżenia napięcia chirurgicznego w wodzie. Ponadto jego produkcja jest bardzo tania.
Z tego powodu sulfoniany olejowe są wstrzykiwane do istniejących studni olejowych, pomagając odzyskiwać ropę naftową, która jest zamykana między skałami pod powierzchnią.
W preparacie smarów i antykorozyjnych
Sulfoniany magnezu mają szerokie zastosowanie w formułach smarowych, takich jak dodatki do dyspergowania i unikanie zużycia.
Sulfoniany baru są stosowane w środkach smarowych antyflintowych do zastosowań stosowanych w aplikacjach o wysokiej prędkości. Sulfoniany sodu i wapnia mają smary i tłuszcze tłuszczowe w celu poprawy właściwości ekstremalnych ciśnienia.
Sole magnezowe kwasu sulfonowego są również przydatne w zastosowaniach antykoorozyjnych, takich jak powłoki, tłuszcze i żywice.
Bibliografia
- Falk, Michael i Giguere, Paul A. (1958). O naturze kwasu siarkowego. Canadian Journal of Chemistry, t. 36, 1958. Odzyskane z NRCRESEARKPress.com
- Betts, r.H. i voss, r.H. (1970). Kinetyka wymiany tlenu między jonem siarczkowym a wodą. Canadian Journal of Chemistry, t. 48, 1970. Odzyskane z NRCRESEARKPress.com
- Bawełna, f.DO. I Wilkinson, G. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. Rozdział 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 23. Czwarta edycja. John Wiley & Sons.
- Kosswig, Kurt. (2012). Środki powierzchniowo czynne. Ullmann's Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.
- « Struktura dwutlenku chloru (CLO2) wykorzystuje, uzyskiwanie, ryzyko, właściwości
- Struktura kwasu poliaktycznego, właściwości, synteza, zastosowanie »

