Struktura dimetyloaminy ((CH3) 2NH), właściwości, zastosowania, ryzyko
- 4277
- 1015
- Herbert Wróblewski
dimetyloamina Jest to związek organiczny utworzony przez dwie grupy metylowe -ch3 Zjednoczone z grupą -nh. Jego formuła chemiczna jest (Cho3)2NH. To jest bezbarwny gaz. Kiedy zapach ryb jest postrzegany w powietrzu w niskich stężeniach. Jeśli jednak jest w wysokim stężeniu, ma zapach amoniaku NH3.
Dimetyloamina jest obecna u roślin i zwierząt. Uważa się, że w ludziach pochodzi z rozkładu niektórych enzymów, ale także z spożycia niektórych pokarmów, takich jak ryby. Jeśli gaz dimetyloaminy rozpuszcza się w wodzie, tworzy bardzo zasadowe i korozyjne roztwory.
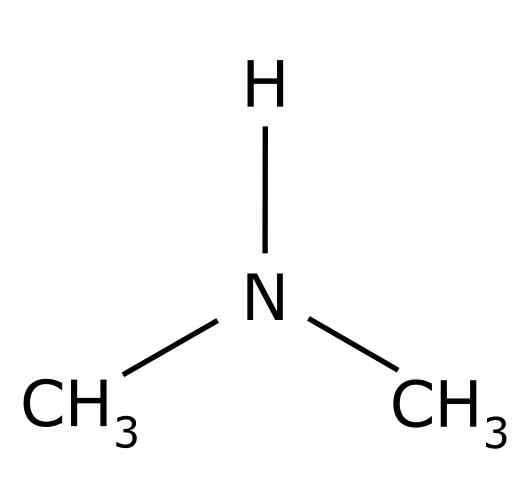
 Dimetyloamina. Ring0 [domena publiczna]. Źródło: Wikimedia Commons.
Dimetyloamina. Ring0 [domena publiczna]. Źródło: Wikimedia Commons. Ma różne zastosowania przemysłowe, takie jak wytwarzanie rozpuszczalników, w celu przyspieszenia wulkanizacji gumy.
Dimetilamina jest bardzo łatwopalnym gazem. Pojemniki, które go zawierają. Ponadto ich opary to drażniące oczy, skóra i dróg oddechowy.
Jest to związek, który może być częścią aerozoli atmosferycznych, to znaczy bardzo cienkich kropel występujących w atmosferze.
[TOC]
Struktura
Dimetilamina jest wtórną aminą alifatyczną. Oznacza to, że podstawniki azotu (N) są alifatyczne (-ch3), co oznacza, że nie są aromatyczne i że są dwa. Dlatego są dwa metyl -ch3 Zjednoczony azot, który ma również wodór (H).
W cząsteczce dimetyloaminy azot (N) ma parę wolnych elektronów, to znaczy kilka elektronów, które nie są zjednoczone z żadnym innym atomem.
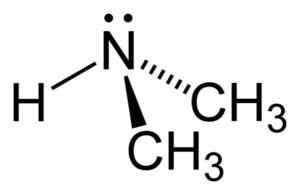 Struktura dimetyloaminy. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Struktura dimetyloaminy. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Nomenklatura
- Dimetyloamina
- N, N-dimetyloamina
- N-metylometanamina
- DMA (akronim dla di-metyloaminy).
Nieruchomości
Stan fizyczny
Bezbarwny gaz.
Waga molekularna
45,08 g/mol
Temperatura topnienia
-93 ° C
Punkt wrzenia
7,3 ° C
Temperatura zapłonu
-6,69 ° C (metoda zamkniętej kubka).
Temperatura samo -kierunkowego
400 ° C
Może ci służyć: Prawo o wielu proporcjachGęstość
Ciecz = 0,6804 g/cm3 A 0 ° C.
Para = 1,6 (gęstość względna w odniesieniu do powietrza, powietrze = 1).
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 163 g/100 g wody w 40 ° C. Rozpuszczalne w etanolu i eterze etylowym.
Ph
Wodne roztwory dimetyloaminy są silnie alkaliczne.
Stała dysocjacji
KB = 5,4 x 10-4
PkDo kwasu sprzężonego = 10 732 do 25 ° C. Kwas koniugate to jon dimetyloamoniowy: (Cho3) NH2+
Właściwości chemiczne
Płyn dimetyloamina może atakować niektóre tworzywa sztuczne, opony i powłoki.
Podczas rozpuszczania się w wodzie para elektronów bez azotu (N) przyjmuje proton (H+) wody, pozostawiając OH za darmo-, Więc tworzy bardzo alkaliczne i żrące roztwory:
Dimetyloamina + woda → jon dimetyloamoniowy + jon hydroksylowy
(Ch3)2NH + H2O → (Wybierz3)2NH2+ + Oh-
Z kwasem azotowym uzyskuje się sól azotanową, to znaczy azotan dimetyloa amotyloamoniowy:
Dimetyloamina + kwas azotowy → azotan dimetyloamoniowy
(Ch3)2NH +HNO3 → (rozdz3)2NH2+NIE3-
Inne właściwości
Kiedy w niskim stężeniu powietrza ma zapach podobny do ryb, podczas gdy w wysokich stężeniach pachnie jak amoniak (NH3).
Reakcje biochemiczne
W organizmie dimetyloamina może cierpieć nitrylary w słabo kwaśnych warunkach, aby podać dimetylonitrozaminę związkę rakotwórczych (CH3)2N-no.
Tworzenie dimetlnitrozaminy występuje z dimetyloaminy i azotynu (azotyn sodu) w żołądku (pH 5-6) przez działanie bakterii istniejących w przewodzie pokarmowym. Azotyn sodu jest obecny w niektórych produktach spożywczych.
Dimetyloamina + azotyn sodu → dimetylyntrozamina + wodorotlenek sodu
(Ch3)2NH + Nano2 → (rozdz3)2N-no + naoh
Uzyskanie
Dimetamina jest przygotowywana na rynku przez reakcję metanolu (wybierz3Och) z amoniakiem (NH3) w 350-450 ° C w obecności katalizatora krzemionkowego (SIO2/Do2ALBO3).
2 Ch3OH + NH3 → (rozdz3)2NH + 2 H2ALBO
Ponieważ wytwarzane są również monometyloamina i trimetyloamina, w serii czterech do pięciu kolumn destylacyjnych wykonuje się oczyszczenie.
Obecność w naturze
Dimetyloamina występuje u roślin i zwierząt. Jest również obecny naturalnie i obficie w ludzkim moczu.
Może ci służyć: epoksyd: nomenklatura, uzyskiwanie, aplikacje, przykładySzacuje się, że jego obecność u ludzi wynika z faktu, że niektóre rodzaje bakterii jelitowych są wytwarzane z niektórych związków znalezionych w żywności.
Niektóre z tych związków to wzgórze (związek związany z grupą witaminy B) i tlenkiem trimetyloaminy. Uważa się również, że pochodzi on z inhibitora enzymu tlenku azotu (NO), który powstaje w organizmie.
Niektóre źródła informacji wskazują, że wzrost dimetyloaminy w moczu jest spowodowany spożyciem ryb i owoców morza, gdzie uzyskuje się główne wartości, gdy jedzą kałamarnice, hake, sardynki, mieczanie, dorsz, ryby i linię.
 Jedzenie ryb może zwiększyć poziom dimetyloaminy w moczu. Autor: Anna Sulenca. Źródło: Pixabay.
Jedzenie ryb może zwiększyć poziom dimetyloaminy w moczu. Autor: Anna Sulenca. Źródło: Pixabay. Pacjenci z nadmiarem dimetyloaminy
Uważa się, że dimetyloamina jest toksyną moczkową, to znaczy substancją, która może powodować uszkodzenie, jeśli jej stężenie w moczu jest podniesione. W rzeczywistości zaobserwowano bardzo wysoki poziom dimetyloaminy u pacjentów z chorobą nerek na etapie końcowym.
Uważa się, że u tych pacjentów może wystąpić przeludnienie bakterii jelitowych, które mogą to wytwarzać.
Aplikacje
DMA lub DMA stosuje się dla:
- Przygotowanie innych związków.
- Produkcja rozpuszczalników dimetyloformamidu i dimetyloacetamidu.
- Przyspieszyć wulkanizację niektórych dziąseł.
- Wyeliminuj włosy podczas opalania.
- Działać jako przeciwutleniacz dla rozpuszczalników.
- Służyć jako mineralny agent flotacyjny.
- Hamować korozję i jako środek antynosowy.
- Funkcjonować jako środka powierzchniowo czynne.
- Rób mydła i detergenty.
- Działaj jako chemik w tekstyliach.
- Funkcjonować jako środek przeciw datowaniu w paliwach i stabilizator gazu.
- Przygotuj barwniki.
- Pochłaniają kwasowe gazy.
- Służyć jako pestycydy i rakiety.
- Być częścią agentów do uzdatniania wody.
- Działaj jako fungicydy w produktach agrochemicznych.
- Już zaprzestane zastosowania, takie jak przyciąganie i eksterminacja gorgjos lub owadów atakujących bawełnę.
 Bawełniana roślina. Autor: Isaa KC. Źródło: Pixabay.
Bawełniana roślina. Autor: Isaa KC. Źródło: Pixabay.  W przeszłości owady atakujące bawełniane rośliny zostały wyeliminowane dimetyloaminą. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
W przeszłości owady atakujące bawełniane rośliny zostały wyeliminowane dimetyloaminą. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Ryzyko
Opary dimetaminy to drażniący skóra, oczy i dróg oddechowy.
Może ci służyć: związki nieorganiczneJeśli kontaktujesz się ze skórą w postaci płynnej, może powodować zamrażanie i spalanie chemiczne. Jego wdychanie ma niekorzystne skutki zdrowotne.
Gaz DMA jest żrący i może tworzyć korozyjne roztwory wodne. Twoje wodne roztwory mogą stać się łatwopalne, chyba że są dość rozcieńczone.
Dimetyloamina w kształcie gazu jest łatwo zapalona przez wytwarzanie toksycznych oparów tlenków azotu (nieX).
Jeśli pojemnik zawierający ten gaz jest narażony na intensywne ciepło lub ciepło, może eksplodować.
Wpływ DMA w atmosferze
Aerozol atmosferyczny (bardzo małe kropelki mieszaniny naturalnych związków i/lub zanieczyszczeń w atmosferze) ma głęboki wpływ na globalną jakość klimatu i powietrza w różnych regionach świata.
Tworzenie nowych cząstek aerozolu nie jest jeszcze w pełni zrozumiałe.
Szacuje się, że dimetyloamina uczestniczy wraz z innymi związkami w tworzeniu tych cząstek, co wydaje się zależeć od obszaru silnej emisji DMA.
Na przykład na obszarach przemysłowych istnieje większa koncentracja niż na obszarach rolnych, co może wpłynąć na sposób uczestnictwa DMA.
Należy zauważyć, że według niektórych naukowców spalanie materiału roślinnego zawierającego glifosat (jeden z herbicydów najczęściej stosowanych na świecie) może prowadzić do tworzenia dimetyloaminy.
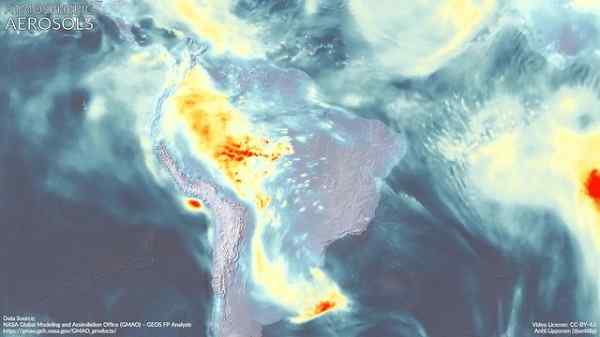 Aerozole atmosferyczne w Ameryce Południowej. Dimetilamina może przyczynić się do jej powstawania. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Aerozole atmosferyczne w Ameryce Południowej. Dimetilamina może przyczynić się do jej powstawania. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Bibliografia
- LUB.S. National Library of Medicine. (2019). Dimetyloamina. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Morrison, r.T. i Boyd, r.N. (2002). Chemia organiczna. 6. edycja. Prentice-Hall.
- Windholz, m. i in. (redaktorzy) (1983). Indeks Merck. Enyklopedia chemikaliów, leków i biologicznych. Wydanie dziesiąte. Merck & Co., Inc.
- Abramowitz, m.K. i in. (2010). Patofizjologia moczówki. Alifatyczne aminy. W przewlekłej chorobie nerek, dializie i przeszczepie (wydanie trzecie). Odzyskane z naukowym.com.
- Li, h. i in. (2019). Wpływ warunków atmosferycznych na tworzenie nowych cząstek opartych na kwasie siarkowym-dimetyloaminy-amonia. Chosfer 2019; 245: 125554. NCBI odzyskało.NLM.Nih.Gov.
- Mackie, J.C. i Kennedy i.M. (2019). Piroliza glifosatu i piosenek toksyczne produkty. Środowisko. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI odzyskało.NLM.Nih.Gov.

