Boltzmann Stała historia, równania, obliczenia, ćwiczenia

- 3123
- 573
- Pani Gilbert Stolarczyk
Boltzmann stała Jest to wartość, która dotyczy średniej energii kinetycznej układu termodynamicznego lub obiektu o temperaturze bezwzględnej tej samej. Chociaż są często zdezorientowane, temperatura i energia nie są tym samym koncepcją.
Temperatura jest miarą energii, ale nie samą energią. Z stałą Boltzmanna jest połączona ze sobą w następujący sposób:
IC = (3/2) kB T
 Boltzmann gospodarz w Wiedniu. Źródło: Dadotet w angielskiej Wikipedii [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Boltzmann gospodarz w Wiedniu. Źródło: Dadotet w angielskiej Wikipedii [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] To równanie jest ważne dla idealnej cząsteczki gazowej monoatomicznej M, Gdzie IC To jego energia kinetyczna podana w dżule, KB To jest stała Boltzmanna i T Jest to temperatura bezwzględna w Kelvin.
W ten sposób, gdy temperatura rośnie, wzrasta również średnia energia kinetyczna według cząsteczki substancji, zgodnie z oczekiwaniami. I odwrotnie dzieje się, gdy temperatura maleje, możliwość osiągnięcia punktu, w którym przestaje cały ruch, osiągana jest najniższa możliwa lub bezwzględna temperatura.
Mówiąc o średniej energii kinetycznej, należy pamiętać, że energia kinetyczna jest związana z ruchem. A cząsteczki mogą poruszać się na wiele sposobów, na przykład poruszać się, obracać lub wibrujące. Oczywiście, nie wszyscy zrobią to w ten sam sposób, a ponieważ są niezliczone, wówczas średnia jest podejmowana w celu scharakteryzowania systemu.
Niektóre stany energetyczne są bardziej prawdopodobne niż inne. Ta koncepcja ma radykalne znaczenie w termodynamice. Energia rozważana w poprzednim równaniu jest energią kinetyczną translacji. Prawdopodobieństwa państw i ich relacji z stałą Boltzmanna będzie mówić nieco później.
W 2018 r. Kelvin został na nowo zdefiniowany, a wraz z nim Boltzmann stała, która w systemie międzynarodowym wynosi około 1.380649 x 10-23 J. K-1. Można osiągnąć znacznie większą precyzję dla stałej Boltzmanna, która została określona w wielu laboratoriach na całym świecie, różnymi metodami.
[TOC]
Historia
Słynna stała zawdzięcza swoją nazwę fizykowi Ludwigowi Boltzmannowi (1844–1906), urodzonym w Wiedniu, który poświęcił swoje życie jako naukowca badaniu statystycznego zachowania systemów z wieloma cząsteczkami, z punktu widzenia mechaniki newtonowskiej.
Chociaż dziś istnienie atomu jest powszechnie akceptowane, w dziewiętnastym wieku przekonanie o tym, czy atom naprawdę istniał, czy był sztuką, z którą wyjaśniono wiele zjawisk fizycznych.
Może ci służyć: normalny wektor: obliczenia i przykładBoltzmann był silnym obrońcą istnienia atomu, a w swoim czasie spotkał się z ostrą krytyką swojej pracy wielu kolegów, którzy uznali, że zawierają nierozpuszczalne paradoksy.
Oświadczył, że obserwowalne zjawiska na poziomach makroskopowych można wytłumaczyć właściwościami statystycznymi cząstek składowych, takich jak atomy i cząsteczki.
Ta krytyka może wynikać z głębokiego epizodu depresji, który doprowadził go do odebrania sobie życia na początku września 1906 r., Kiedy to miał wiele do zrobienia, ponieważ był uważany za jednego z wielkich fizyków teoretycznych swoich czasów i tam. było niewiele, że inni naukowcy przyczynią się do potwierdzenia prawdziwości swoich teorii.
Nie zdarzyło się to długo po jego śmierci, kiedy nowe odkrycia dotyczące natury atomu i jego cząstek składowych zostaną dodane, aby dać powód Boltzmannowi.
Boltzmann's Constant and Planck's Works
Teraz stała Boltzmanna kB Został wprowadzony, jak jest znany dzisiaj po pracy austriackiego fizyka. To Max Planck, w jego prawie emisji czarnego ciała, dzieło, które przedstawił w 1901 r., Dał mu wartość 1,34 x 1023 J/k.
Do 1933 r. Boltzmann został dodany do Wiednia jako hołd plakatowy tablica z definicją entropii obejmującej słynną stałą: S = kB Log w, równanie, które zostanie omówione później.
Dziś stała Boltzmanna jest niezbędna w stosowaniu praw termodynamicznych, mechaniki statystycznej i teorii informacji, których pola, które ten fizyk ze smutnym końcem był pionierem.
Wartość i równania
Gazy można opisać w kategoriach makroskopowych, a także w kategoriach mikroskopowych. Dla pierwszego opisu istnieją pojęcia, takie jak gęstość, temperatura i ciśnienie.
Należy jednak pamiętać, że gaz składa się z wielu cząstek, które mają globalną tendencję do pewnego zachowania. To ten trend jest mierzony makroskopowo. Jednym ze sposobów określenia stały Boltzmanna jest dzięki dobrze znanym równaniu gazów idealnych:
P.V = n. R. T
Tutaj P To ciśnienie gazowe, V To jego głośność, N Jest to liczba obecnych moli, R Jest to stała gazów i T To jest temperatura. W mol z gazu idealnego spełnia się następujący związek między produktem P.V, i energia kinetyczna tłumaczenia K Cały zestaw to:
Może ci służyć: korpusowy model materiiP.V = (2/3). K
Dlatego energia kinetyczna jest:
K = (3/2) n.R.T
Dzieląc przez całkowitą liczbę obecnych cząsteczek, które będą nazywane n, uzyskuje się średnią energię kinetyczną pojedynczej cząstki:
IC = K /n
IC= (3/2N) n.R.T
W mol istnieje liczba cząstek nDO, I dlatego całkowita liczba cząstek jest N = nnA, pozostanie:
IC = (3/2NNDO) N.R.T
Dokładnie iloraz R/nDO Jest to stała Boltzmanna, wykazana, że energia kinetyczna średniej translacji cząstki zależy tylko od temperatury bezwzględnej, a nie innych wielkości, takich jak ciśnienie, objętość lub nawet rodzaj cząsteczki:
IC = (3/2) kB. T
Stała i entropia Boltzmanna
Gaz ma daną temperaturę, ale temperatura ta może odpowiadać różnym wewnętrznym stanom energii. Jak wizualizować tę różnicę?
Rozważ jednoczesne uruchomienie 4 monet i sposobów, w jakie mogą upaść:
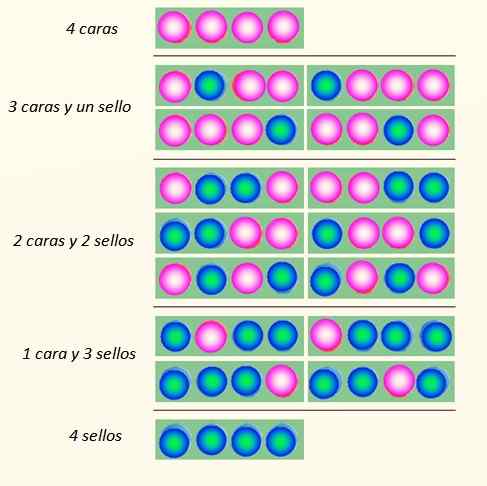 Sposoby, w jakie 4 monety mogą spaść. Źródło: Self Made
Sposoby, w jakie 4 monety mogą spaść. Źródło: Self Made Zestaw monet może przyjąć w sumie 5 stanów, które są rozważane Makroskopijny, opisane na rysunku. Który z tych stanów czytelnik powiedziałby, że jest to najbardziej prawdopodobne?
Odpowiedź powinna być stan 2 powierzchni i 2 krzyże, ponieważ ma ona łączną 6 możliwości, 16 ilustrowanych na rysunku. I 24 = 16. Są one równoważne państwom mikroskopijny.
A co, jeśli uruchomi się 20 monet zamiast 4? Byłoby w sumie 220 możliwości lub „stany mikroskopowe”. Jest to znacznie większa i trudniejsza liczba. Aby ułatwić zarządzanie dużą liczbą, logarytmy są bardzo odpowiednie.
Teraz wydaje się, że państwo z największym zaburzeniem jest najbardziej prawdopodobne. Najczęściej uporządkowane stany, takie jak 4 twarze lub 4 znaczki, są nieco mniej prawdopodobne.
Entropia stanu makroskopowego S jest zdefiniowana jako:
S = kB Ln w
Gdzie W Jest to liczba możliwych stanów mikroskopowych i kB To jest stała Boltzmanna. Jak Ln w Jest bezwymiarowy, entropia ma takie same jednostki co kB: Joule/k.
To jest słynne równanie w nagrobku Boltzmanna w Wiedniu. Jednak bardziej niż entropia istotna jest jej zmiana:
Może ci służyć: zmienne termodynamiczne: które są i ćwiczenia rozwiązaneΔS = kB Ln w2 - kB Ln w1 = kB LN (w2/w1)
Jak oblicza się KB?
Wartość stałej Boltzmanna jest uzyskiwana eksperymentalnie precyzyjnie z pomiarami opartymi na Termometria akustyczna, które są przeprowadzane za pomocą właściwości, która ustanawia zależność od prędkości dźwięku w gazie o temperaturze tej samej.
Rzeczywiście, prędkość dźwięku w gazie jest podana przez:

BAdiabatyczne = γP
A ρ to gęstość gazu. Dla poprzedniego równania, P Jest to ciśnienie omawianego gazu i γ Jest to współczynnik adiabatyczny, którego wartość dla określonego gazu znajduje się w tabelach.
Instytuty metrologiczne doświadczają również innych sposobów pomiaru stałej, takich jak Johnson Noise Thermometry, który wykorzystuje fluktuacje termiczne, które występują losowo w materiałach, w szczególności u sterowników.
Rozwiązane ćwiczenia
-Ćwiczenie 1
Znajdować:
a) Energia kinetyczna średniej tłumaczenia IC który ma idealną cząsteczkę gazową w temperaturze 25 ° C
b) energia kinetyczna tłumaczenia K cząsteczek w 1 mol tego gazu
c) Średnia prędkość cząsteczki tlenu w temperaturze 25 ° C
Fakt
Mtlen = 16 x 10 -3 kg/mol
Rozwiązanie
Do) IC = (3/2) k t = 1.5 x 1.380649 x 10-23J. K-1 x 298 k = 6.2 x 10-dwadzieścia jeden J
B) K = (3/2) n.R.T = 5 x 1 mol x 8.314 J/mol .K x 298 k = 3716 j
C) IC = ½ mV2, Biorąc pod uwagę, że cząsteczka tlenu jest dwuatomiczna, a masę molową musi zostać pomnożona przez 2, będzie:
 -Ćwiczenie 2
-Ćwiczenie 2
Znajdź zmianę entropii, gdy 1 mol gazu zajmował objętość 0.5m3 Rozszerza się, aby zajmować 1 m3.
Rozwiązanie
ΔS = kB LN (w2/w1)
W2= 2NW1 (Było 24 Pamiętaj, że stany mikroskopowe do uruchomienia 4 monet?)
Gdzie n jest liczbą cząstek obecnych w 0.5 mol gazu 0.5 x nDO:
ΔS = kB LN (2N W1/w1) = kB LN 2N= kB 0.5nDO LN 2 = 2.88 J/k
Bibliografia
- Atkins, str. 1999. Chemia fizyczna. Omega Editions. 13-47.
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill. 664-672.
- Giancoli, zm. 2006. Fizyka: zasady z aplikacjami. 6th ... Ed Prentice Hall. 443 -444.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z nowoczesną fizyką. 14. Wyd. Tom 1. 647-673.
- Jeśli redefinicja. Kelvin: Boltzmann Constant. Odzyskane z: NIST.Gov

