Tworzenie związków binarnych, typy, przykłady, nomenklatura
- 1394
- 316
- Marianna Czarnecki
Związki binarne Wszystkie są tworzone przez dwa elementy chemiczne, niezależnie od liczby ich atomów lub interakcji. Ogólny wzór dla tych związków jestNBM, gdzie A i B są dwoma różnymi elementami stolika okresowego i N I M Ich odpowiednie współczynniki stechiometryczne.
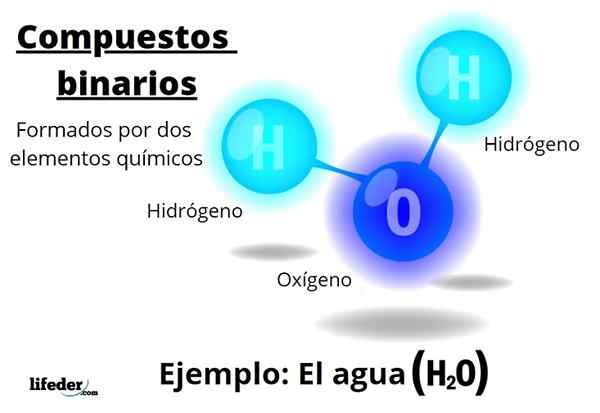
Na przykład woda, h2Lub jest to związek binarny, być może najbardziej reprezentatywnym z nich. Woda składa się z wodoru, H i tlenu lub, dodając w ten sposób dwa pierwiastki chemiczne. Zauważ, że jego współczynniki stechiometryczne wskazują, że istnieją dwa atomy wodoru i jeden.

Związki binarne mogą składać się z jonów, cząsteczek, trzech wymiarów, a nawet neutralnych atomów metali. Ważne jest to, że niezależnie od natury jego wiązania chemicznego lub składu jest zawsze tworzone przez dwa różne elementy chemiczne. Na przykład gaz wodorowy, h2, nie liczy się jako związek binarny.
Związki binarne mogą początkowo nie wydawać się tak obfite i złożone w porównaniu z związkami trójskładnikowymi lub czwartorzędowymi. Jednak wśród nich jest wiele podstawowych substancji ekosystemów naziemnych, takich jak sole, tlenki, sulfidy i niektóre gazy o ogromnej wartości biologicznej i przemysłowej.
[TOC]
Jak wyglądają związki binarne?
Metody przygotowania lub drogi syntetyczne do tworzenia związków binarnych będą zależeć od tożsamości dwóch pierwiastków chemicznych A i B. Jednak w zasadzie i ogólnie oba elementy muszą być łączone w reaktorze, aby mogły one wchodzić w interakcje. Tak więc, jeśli warunki są sprzyjające, nastąpi reakcja chemiczna.
Mając reakcję chemiczną, pierwiastki A i B połączą się lub połączą (jonowe lub kowalencyjne), aby utworzyć związekNBM. Wiele związków binarnych może być utworzone przez bezpośrednią kombinację ich dwóch czystych elementów lub przestrzeganie innych bardziej ekonomicznie opłacalnych metod alternatywnych.
Może ci służyć: tlenk cynkowy (ZnO): struktura, właściwości, zastosowania, ryzykoPowrót do przykładu wody, wodoru, h2, i tlen, lub2, Łączą się w wysokich temperaturach, dzięki czemu istnieje między nimi reakcja spalania:
2h2(g) + lub2(g) → 2H2O (g)
Z drugiej strony woda można uzyskać poprzez reakcje odwodnienia związków, takich jak alkohole i cukry.
Kolejny przykład tworzenia związku binarnego odpowiada siarczku żelaza, FES:
Wiara (S) + S (S) → FES (S)
Gdzie tym razem zarówno żelazo, jak i siarka są stałe, a nie substancje sodowe. I to jest to samo z kilkoma solami binarnymi, na przykład chlorek sodu, NaCl, łączący metaliczny sód z gazami chloru:
2na (S) + Cl2(g) → 2nacl (s)
Nomenklatura
Nazwy wszystkich związków binarnych są w większości regulowane przez te same zasady.
Dla związku doNBM, Nazwa B jest wspomniana jako pierwsza w formie anionowej; to znaczy z końcem -uro. Jednak w przypadku, że B składa się z tlenu, nazywa się go tlenek, nadtlenkiem lub nadtlenkiem w miarę zastosowania.
Nazwa B jest poprzedzona greckim prefiksami liczbowymi (Mono, DI, Tri, Tetra itp.) zgodnie z wartością M.
Wreszcie, wymieniona jest nazwa elementu A. W przypadku, gdy ma więcej niż jedną wartościowość, jest to wskazane liczbami rzymskimi i w nawiasach. Lub jeśli wolisz, możesz wybrać tradycyjną nomenklaturę i użyć sufiksów -ooso e -ico. Element A czasami jest również poprzedzony greckim prefiksem liczbowym w zależności od wartości N.
Rozważ następujące związki binarne wraz z ich odpowiednimi nazwami:
-H2O: Tlenek wodoru lub tlenek dihydrogenu (to nazwisko jest przyczyną dokuczania)
-FE: siarczek żelaza (II) lub siarczku żelaza
-NaCl: chlorek sodu lub chlorek sodu
Może ci służyć: olej lub eter benzyny: formuła, struktura, zastosowania-MGCL2: Chlorek magnezu, chlorek magnetyczny lub dichlorek magnezu
Zwróć uwagę, że nie powiedziano „chlorku monosodowego” lub „monohierro -siarczek”.
Rodzaje: Klasyfikacja związków binarnych
Związki binarne są klasyfikowane zgodnie z tym, co powstają lub fakty: jony, cząsteczki, atomy metali lub sieci. Mimo to ta klasyfikacja nie jest całkowicie rozstrzygająca ani ostateczna, jest w stanie się różnić w zależności od rozważanego podejścia.
joński
W jonowych związkach binarnych A i B składają się z jonów. Zatem dla związkuNBM, B jest zwykle anionem, b-, Podczas kationu, aby+. Na przykład NaCl należy do tej klasyfikacji, a także wszystkich soli binarnych, których ogólne wzory są lepiej reprezentowane jako MX, gdzie x jest anionem, a M A Metallic Cation.
Zatem fluorki, chlorki, bromuros, jodek., Należą również do tej klasyfikacji. Należy jednak zauważyć, że niektóre z nich są kowalencyjne, a zatem należą do następującej klasyfikacji.
Kowalencyjny
Kowalencyjne związki binarne powstają przez cząsteczki. Woda należy do tej klasyfikacji, ponieważ składa się z cząsteczek H-O-H. Chlorek wodoru, HCl, jest również uważany za kowalencyjny związek binarny, ponieważ składa się z cząsteczek H-Cl. Zauważ, że NaCl jest jonowy, podczas gdy HCl jest kowalencyjny.
Metal lub sieci
Związki binarne obejmują również stopy i substancje stałe trzech wymiarów sieci. Jednak dla nich denominacja materiałów binarnych jest zwykle lepiej stosowana.
Na przykład mosiądz, więcej niż związek, jest uważany za materiał binarny lub stop, ponieważ jest tworzony przez miedź i cynk, cu-zn. Zauważ, że nie jest napisane przez nie zdefiniowane współczynniki stechiometryczne.
Podobnie, jest dwutlenek krzemu, Sio2, utworzone przez krzem i tlen. Ich atomy są powiązane przez definiowanie sieci trójwymiarowej, w której nie można mówić o cząsteczkach lub jonach. Wiele azotków, fosfonu i węglików, gdy nie są jonowe, dotyczy również tego rodzaju sieci.
Może ci służyć: kwas fenoksyoctowy: synteza, procedura, stosowanie, ryzykoPrzykłady związków binarnych
 Woda jest przykładem związku binarnego
Woda jest przykładem związku binarnego Zostanie wymieniony, aby ukończyć kilka związków binarnych wraz z ich nazwami:
-Libr: Bromid litowy
-Cacl2: chlorek wapnia
-Fecl3: chlorek żelaza (iii) lub chlorek żelazowy
-NAO: Tlenek sodu
-Beh2: wodorek berylu
-WSPÓŁ2: dwutlenek węgla
-NH3: Azot lub trójzatku amoniak
-PKB2: Ołowiany jodek (ii) lub ołowiany DIYODURO
-Mg3N2: Magnez nitrruro
-Do2ALBO3: Tlenek aluminiowy lub triorek diauminowy
-Na3P: Phosfuro sodu
-Alf3: Fluor aluminiowy
-Racl2: chlorek radiowy lub dichlorek radiowy
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: Carbide lub Wolframium
Każdy z tych przykładów może mieć więcej niż jedno imię na raz. Spośród nich CO2 Ma to duży wpływ na naturę, ponieważ są używane przez rośliny w procesie fotosyntezy.
Z drugiej strony NH3 Jest to jedna z substancji o największej wartości przemysłowej, niezbędnej do syntezy syntezy polimerowej i organicznej. I wreszcie, WC jest jednym z najtrudniejszych materiałów, jakie kiedykolwiek stworzono.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Artem Cheprasov. (2020). Co to jest związek binarny? - Definicja i przykład. Badanie. Odzyskane z: Study.com
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Definicja związku binarnego. Odzyskane z: Thoughtco.com
- Byju's. (2020). Jakie są związki binarne? Odzyskane z: Byjus.com
- Chemteam. (S.F.). Związki binarne metali o stałych ładunkach. Odzyskane z: chemteam.Informacje
- Wikipedia. (2020). Faza binarna. Źródło: w:.Wikipedia.org
- « Właściwości azotynów, struktura, nomenklatura, szkolenie
- Flokulacja reakcji, typy, zastosowania, przykłady »

