Właściwości azotynów, struktura, nomenklatura, szkolenie
- 3336
- 897
- Paweł Malinowski
azotyny Są to wszystkie te związki, które nie zawierają anionu2-, Jeśli są nieorganiczni lub grupa -ono, jeśli są organiczne. Zdecydowana większość to azotyny metali, które są solami nieorganicznymi, w których nie2- oddziaływać elektrostatycznie z kationami CN+; Na przykład kation sodu, na+.
Zatem azotyn sodu, nano2, Jest to przykład związku soli lub azotynów. Sole te znajdują się w naturze, albo w glebach, morzach, ssakach i tkankach roślinnych, ponieważ są częścią biologicznego cyklu azotu. Dlatego nie2- Jest to substancja obecna w naszych organizmach i jest powiązana z procesami rozszerzania naczyń.
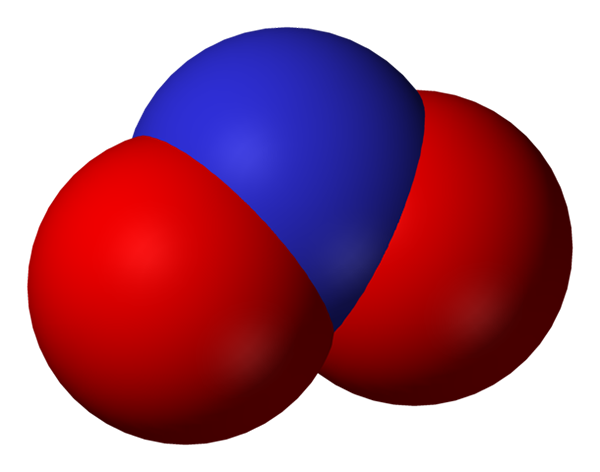
 Przestrzeń pełna anionu azotynowego. Źródło: Benjah-BMM27.
Przestrzeń pełna anionu azotynowego. Źródło: Benjah-BMM27. Azotyn staje się mniejszą postacią azotu lub mniej utlenionego, niż azotan, nie3-. Z niego występuje tlenek azotu, nie w regionach organizmu, w których występuje niedobór tlenu. Nie jest cząsteczką sygnalizacyjną, która wywiera efekt rozszerzania naczyń krwionośnych poprzez rozluźnienie mięśni i tętnic.
Z biochemii i medycyny azotyny są stosowane jako bakterycydy, co jest ich agregacją dla dość powszechnych mięs. To w celu ich wyleczenia i dłuższego rozszerzenia ich jakości i świeżości.
Azotyn ma dwie twarze: jedna korzystna dla zdrowia, a druga, która naraża go na niebezpieczeństwo. Dobra twarz jest właśnie spowodowana reakcjami, które je zmniejszają. Tymczasem zła twarz wynika z jej transformacji do nitrozaminy: rodzina związków organicznych, które mają kilku członków, którzy zostali uznani za substancje rakotwórcze.
[TOC]
Właściwości azotynów
Zasadowość
Azotyny są solami podstawowymi, ponieważ anion nie2- Jest to skoniugowana podstawa kwasu azotowego, HNO2:
Hno2 + H2Lub ⇌ nie2- + H3ALBO+
W wodzie i w kilku ilościach jest hydrolizowane, aby pochodzić-:
NIE2- + H2Lub ⇌ hno2 + Oh-
Ta zasadowość jest nieodłączna dla wszystkich soli azotynowych, ponieważ nie zależy od tego2- i nie z kationów, które mu towarzyszą. Jednak te kationy i ich interakcje z nie2- Wpływają one na rozpuszczalność soli azotynowych w wodzie i innych rozpuszczalnikach polarnych.
Reakcje
Reakcje azotynów różnią się w zależności od tego, które kationów towarzyszą NO2-, lub czy jest to azotyn organiczny, Rono. Ogólnie rzecz biorąc, azotyny mogą rozkładać, utleniać lub zmniejszać do: tlenków metali, nie3-, NIE2, Nie, a nawet gaz azotowy, n2.
Może ci służyć: procesy termodynamiczneNa przykład azotyn amonu, NH4NIE2 może rozłożyć się na n2 i H2ALBO.
Wygląd zewnętrzny
Prawie wszystkie azotyny są stałą krystalicznego wyglądu. Wiele ma białawe lub żółtawe kolory, chociaż są kolorowe, jeśli zawierają one kationów metali przejściowych.
Z drugiej strony głównie azotyny organiczne są wysoce niestabilne i wybuchowe lotne ciecze.
Struktura
Anion azotyny
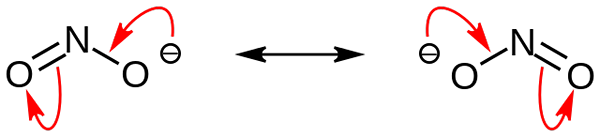 Struktury rezonansu anionowego azotynowego. Źródło: domena Nohingserius / Pub
Struktury rezonansu anionowego azotynowego. Źródło: domena Nohingserius / Pub Na pierwszym zdjęciu anion azotyny pokazano za pomocą modelu pełnego przestrzeni. Ten model ma wadę, która jest dokładnie taka sama jak w przypadku dwutlenku azotu, nie2. Z drugiej strony, lepszy obraz opisuje anion azotyny lepiej i jak zachowuje się jego obciążenie ujemne.
Obciążenie to przenosi się między dwoma atomami tlenu, więc każdy ma połowę wspomnianego obciążenia ujemnego (-1/2). I to negatywne obciążenie odpowiedzialne za przyciąganie otaczających kationów z powodu prostej atrakcji elektrostatycznej.
Solidki
Azotyny nieorganiczne to krystaliczne związki stałe. Jego interakcje są czysto elektrostatyczne, mające przyciąganie między NO2- i kationów mN+. Zatem na przykład nano2 Ma ortorombową strukturę krystaliczną i jest tworzona przez jony NA+ i nie2-.
Rodzaj struktury krystalicznej będzie zależeć od tożsamości m+N, Więc nie wszystkie azotyny mają strukturę ortorombową.
Azotyny organiczne
Azotyny organiczne, w przeciwieństwie do nieorganicznych, nie są związkami jonowymi, ale kowalencyjne. Są zatem utworzone z cząsteczek, które charakteryzują się połączeniem R-Aon, gdzie R może być grupą alkilową lub aromatyczną.
Są uważane za azotowe estry kwasu, ponieważ ich wodór, H-DON, jest zastępowany przez grupę R:
 Ogólna formuła azotynu organicznego. Źródło: PNGBOT przez Wikipedia.
Ogólna formuła azotynu organicznego. Źródło: PNGBOT przez Wikipedia. Zgodnie z górnym obrazem estr ten można zapisać jako rum = o, bardzo podobny do wzoru estrów węglowych, ROC = O. Zwróć uwagę na wielkie podobieństwo, jakie ta struktura ma ze strukturą związków nitro, RNO2, gdzie teraz głównym linkiem jest R-no2 a nie r-dono. Jedyna różnica leży zatem w atomie, z którym się łączy2 do grupy r.
Z tego powodu estry azotynowe i związki nitro są uważane za izomery linków, ponieważ mają te same atomy, ale są połączone inaczej.
Złożony
Kompleksy azotynowe mogą mieć zarówno składniki nieorganiczne, jak i organiczne. Tworzą łącznik koordynacyjny między środkiem metalu a jednym z tlenu bez2-. Oznacza to, że nie ma rozmowy o czysto elektrostatycznej interakcji, mN+NIE2-, Ale koordynacji mN+-ALBO NIE-.
Może ci służyć: jakie są fizyczne właściwości materii?Azotyny organiczne i ich kompleksy ustanowi lub nie krystaliczne struktury w zależności od tego, czy ich interakcje udaje się ustawić cząsteczki w przestrzeni.
Nomenklatura
Azotyny nieorganiczne i organiczne mają znacznie prostą nomenklaturę. Aby je wymienić, słowa „azotyn”, a następnie nazwa metalu i jego walencja napisana w nawiasach są pierwsi. Podobnie, zakończenia -co i -so w przypadku użycia więcej niż jednej Walencji można użyć.
Na przykład cuno2 można nazwać na dwa sposoby: azotyn miedzi (i) lub azotyn miedzi.
Ta zasada nomenklatury dotyczy również azotynów organicznych. Na przykład Cho3Ono nazywa się Methilo Aztrito, ponieważ CH3 odpowiada grupie R połączonej z tlenem NO2.
Nomenklatura może stać się skomplikowana, jeśli istnieją inne grupy o równym lub większym znaczeniu chemicznym niż NO2, lub jeśli są to kompleksy metalowe.
Szkolenie
Nitryfikacja
Wiele azotynów nieorganicznych powstaje w naturze w jednym z etapów cyklu azotu: nitryfikacja. Proces ten składa się z utleniania amoniaku przeprowadzanego przez mikroorganizmy, w szczególności przez bakterie Nitrosomonas.
Nitryfikacja obejmuje również późniejsze utlenianie azotanu do azotanu; Jednak tworzenie azotynów jest powolnym krokiem tych reakcji, ponieważ wymaga większej energii i musi pokonać większą barierę kinetyczną.
Poniższe równanie jest przykładem nowo ujawnionego:
2nh4+ + 32 → 2no2- + 4h+ + 2h2ALBO
Kilka enzymów uczestniczy w tej reakcji i powstaje hydroksyloamina, NH2Och, który jest produktem, z którego w końcu pochodzą aniony azotynowe.
To dzięki nitryfikacji rośliny zawierają azotyny, a z kolei zwierzęta, które je spożywają. Azotyny są nie tylko obecne w glebie, ale także w morzach, a prawie cała ich naturalna produkcja wynika z utleniania i beztlenowego działania różnych mikroorganizmów.
Tlenki azotu w podstawowych pożywkach
Azotyny metali alkalicznych można przygotować przemysłowo przez bąbelkowe tlenki azotu w podstawowych roztworach lub pożywkach, z odpowiednich wodorotlenków lub węglanów. Na przykład azotyn sodu występuje zgodnie z następującą reakcją:
No +no2 + Naoh → 2nano2 + H2ALBO
W przypadku azotynu amonowego tritlenek Dyitrogen jest bulgotany w amoniaku:
Może ci służyć: Rodio: Historia, właściwości, struktura, zastosowania, ryzyko2nh3 + H2Lub +n2ALBO3 → 2nh4NIE2
Reakcja z tlenkiem azotowym
Azotyny alquilico, Rono, mogą być syntetyzowane przez React. Ogólna reakcja byłaby następująca:
R-OH → R-Aon
Zastosowanie azotynów
Utwardzanie mięsa
 Czerwony kolor mięsa wynika z lekarstwa z solami azotanowymi i azotanami. Źródło: Pxhere.
Czerwony kolor mięsa wynika z lekarstwa z solami azotanowymi i azotanami. Źródło: Pxhere. Azotyny mają działanie przeciwbakteryjne, więc są dodawane w umiarkowanych ilościach do mięsa, aby spowolnić gnicie. Oprócz spełnienia tej funkcji reagują z białkami mięsnymi, aby nadać im bardziej czerwonawe i atrakcyjne zabarwienie.
Złą stroną tej praktyki jest to, że niektóre mięso mogą mieć zbyt wiele soli azotynowych, a podczas gotowania w wysokich temperaturach przekształcają się w nitrosoaminę. Dlatego istnieje ryzyko zwiększenia szans na zarażenie się pewnym rodzajem raka, jeśli spożywanie tych wyleczonych mięs jest nadmierne.
Rod Barwniki
Azotyny są stosowane w chemii organicznej do realizacji reakcji diazotacji, z którą syntetyzuje się kolorowanie lub barwniki.
Pigmenty
Niektóre kompleksy azotynowe, takie jak kobalt, mogą być stosowane jako pigmenty do obrazów lub porcelany ze względu na ich uderzające zabarwienie.
Rozszerzający naczynia
Azotyny są odpowiedzialne za generowanie tlenku azotu w organizmie w niedoborze tlenu. Nie jest cząsteczką sygnalizacyjną, która reaguje na naczynia krwionośne relaksujące i rozszerzające się. Ta ekspansja lub rozszerzenie ma w konsekwencji zmniejszenie ciśnienia krwi.
Przykłady azotynów
Wreszcie niektóre przykłady azotynów zostaną wymienione z ich odpowiednimi formułami i nazwami:
-Starszy brat2: azotan sodu
-Kno2: azotyn potasu
-Mg (nie2)2: Azotyn magnezu
-Rynna2)2: azotyn wapnia
-Ch3Ch2Ono: azotyn etylowy
-NH4NIE2: azotyn amonu
-Zn (nie2)2: azotyn cynku
-PB (nie2)2: Azotyn ołowiowy (ii) lub azotyn hydrauliczny
-Wiara (nie2)3: Azotyn żelaza (iii) lub azotyn żelazowy
-(Ch3)2Chch2Ch2Ono: Isoamilo Aztrito
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Azotyn. Źródło: w:.Wikipedia.org
- Elsevier b.V. (2020). Azotyn. Scientedirect. Pobrano z: Scientedirect.com
- Alfa Aesar. (2020). Sole azotynowe. Themo Fisher Scientific. Odzyskane z: alfa.com
- Redaktorzy Enyclopaedia Britannica. (23 lutego 2018 r.). Azotyny. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Anthony r. Butler i Martin Feelisch. (22 kwietnia 2018 r.). Terapeutyczne zastosowania nieorganicznego azotynu i azotanu. doi.Org/10.1161/Circulahaha.107.753814
- Kris Gunnars. (10 lutego 2020). Są azotany i azotyny w żywności szkodli? Odzyskane z: Healthline.com
- « Teoria zachowań społecznych, typy, normy, przykłady
- Tworzenie związków binarnych, typy, przykłady, nomenklatura »

