W jaki sposób model Brönsted-Lowry uzupełnia model Arrheniusa?
- 2444
- 147
- Herbert Wróblewski
 Brönsted i Lowry uzupełnili model Arrheniusa, rozszerzając pojęcia kwaśnych substancji i substancji podstawowych
Brönsted i Lowry uzupełnili model Arrheniusa, rozszerzając pojęcia kwaśnych substancji i substancji podstawowych Jakie są modele Brönsted-Lowry i Arrhenius?
Zarówno model Arrheniusa, jak i Brönsted-Lowry opisują dwa rodzaje bardzo ważnych substancji: kwasy i podstawy. Oba uczestniczą w procesach biologicznych i są częścią przydatnych leków i związków.
Kwasy mają charakterystyczny kwaśny smak, podczas gdy podstawy odczuwają mydła w dotyku. Przez długi czas te różnice sensoryczne były tymi, które pomogły je rozróżnić, dopóki szwedzki chemik Svante Arrhenius (1859–1927), pod koniec XIX wieku, ilościowo ustalił rozróżnienie.
Model Arrhenius-base Arrhenius stwierdza, że substancja jest:
- Kwas, Jeśli zwolnisz protony (jony wodoru h+) lub jony hydrono h3ALBO+ W roztworze wodnym.
- Baza, Podczas produkcji jonów wodorotlenkowych (OH-), również w roztworze wodnym.
Ta definicja jest ograniczona tylko do roztworów wodnych. Dlatego nie wyjaśnia, w jaki sposób inne substancje zachowują się również jak kwasy lub zasady, nawet bez rozpuszczania się w wodzie lub nie zawierają jonów wodoru lub hydroksydów.
Stąd dwóch chemików, jeden duński, o imieniu Johannes Brönsted (1879–1949) i inny angielski, Thomas Lowry (1874–1936), niezależnie rozszerzyło definicje Arrheniusa, aby uwzględnić przypadki, w których nie zastanawiał się nad tym.
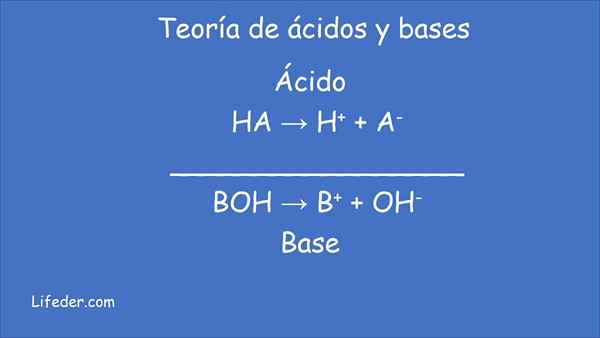
Zgodnie z nową teorią definicja kwasów i zasad jest następująca:
- Kwas Jest to każdy gatunek chemiczny, który daje protony (jony wodoru h+) do innej substancji.
- Baza, Gatunki chemiczne, które akceptują protony (jony wodoru h+) z innej substancji.
 Wodorowęglan sody to zasada i ocet, kwas. Podczas reakcji wytwarzane są bąbelki dwutlenku węgla, sól i wodę sól i wodę. Źródło: Wikimedia Commons
Wodorowęglan sody to zasada i ocet, kwas. Podczas reakcji wytwarzane są bąbelki dwutlenku węgla, sól i wodę sól i wodę. Źródło: Wikimedia Commons Model Arrheniusa
W swojej pracy doktorskiej Svante Arrhenius opracował teorię o Dysocjacja elektrolityczna. Zgodnie z tym istnieją substancje, które wykazują przewodność elektryczną, gdy znajdują się w roztworze wodnym, to znaczy przeprowadzają energię elektryczną.
Może ci służyć: kwasy i zasady w życiu codziennym: reakcje, zastosowania, przykładyTe substancje są Elektrolity. Ich przykład to wspólna sól lub chlorek sodu, rozpuszczony w wodzie, która wytwarza jony (gatunki chemiczne z obciążeniem netto) w roztworze.
W przypadku chlorku sodu w wodzie odpowiednia reakcja wynosi:
NaCl → na+ + Cl-
Podobnie dla podstawy takiej jak wodorotlenek sodu NaOH, w roztworze wodnym, dysocjacja elektrolityczna wynosi:
Naoh → na+ + Oh-
A dla kwasu, również w roztworze wodnym, takim jak HCl Shydrochlorin, masz:
HCl → Cl- + H+
Zachowanie elektrolitów w roztworze wodnym doprowadziło Arrheniusa do klasyfikowania substancji jako kwas-. Dlatego są one nazywane odpowiednio kwasami i zasadami Arrheniusa.
Zaletą tej teorii ujawnia się w reakcjach neutralizacji, w których łącza się kwas i podstawa basiusa. W tym procesie znikają charakterystyczne jony każdego rodzaju substancji+ W kwasach i OH- W podstawach, które wytwarzają wodę.
Na przykład mieszanina wodnego roztworu kwasu chlorowodorowego HCl z wodorotlenkiem sodu NaOH jest typowym przykładem reakcji neutralizacji:
HCl + NaOH → NaCl + H2ALBO
Reakcja między kwasem a podstawą basius wytwarza sól więcej wody, powstała przez reakcję między jonami H+ I och-.
Ograniczenia modelu Arrheniusa
Model Arrhenius był innowacyjny, ponieważ jako pierwszy oferował ilościową definicję kwasu i zasady.
Może ci służyć: zmiany fizyczneWcześniej rozróżnienie między jednym rodzajem substancji należy dokonać za pomocą zmysłów: jeśli substancja jest gorzka, taka jak sok z cytryny lub ocet, jest to kwas; Jeśli jest to śliskie lub mydlane, jest to podstawa.
Arrhenius ustalił, że kwasy zawierają wodór, który po rozpuszczeniu w wodzie zwiększają stężenie jonów wodoru lub czystej wody. Z drugiej strony, poprzez rozpuszczenie podstawy, stężenie jonów OH wzrasta-.
Jednak model ma ważne ograniczenia:
-Pojęcie kwasu i zasady stosuje się tylko w roztworach wodnych, ale wiadomo, że istnieją inne substancje zdolne do zachowania jak jedna lub druga, nawet przy braku wody.
-Istnieją kwasy, które nie zawierają wodoru (na przykład Co2 A więc3) i zasady bez jonów wodorotlenkowych (takich jak amoniak).
-W praktyce jony lub protony wodoru, dodatnio załadowane, nie pozostają wolne w roztworze. Przyciągają elektrycznie cząsteczki wody, które są polarne, powodując jony hydronowe H3ALBO+.
Model Brönsted-Lowry
Ograniczenia ARRHENIUS BASA BASEJ WYKONAŁO KOKCTIONA Rozszerzenie koncepcji. Dlatego do 1923 r. Johannes Brönsted i Thomas Lowry zgodzili się, niezależnie i prawie w tym samym czasie, że kwas lub podstawowy charakter substancji jest nadawany przez jego zdolność do wydania lub akceptacji protonów.
W ten sposób reakcje neutralizacji po prostu polegają na przeniesieniu protonów między kwasem a zasadą. Pierwszy jest w stanie przekazać protony, a drugi jest gotowy ich zaakceptować.
Schematycznie reakcja neutralizacji byłaby taka:
Kwas1 + Baza2 → kwas2 + Baza1
Brönsted-Lowry Acids and Bases
Porównując definicję kwasu podaną przez każdy model, stwierdza się, że kwasy Arrheniusa są również kwasami Brönsted-Lowry. Ale zostanie pamiętane, że istnieją substancje, takie jak amoniak, które rozpuszczają się w wodzie, zachowują się jak baza, nawet bez jonów wodorotlenkowych.
Może ci służyć: wodorotlenek rtęci: struktura, właściwości, zastosowania, ryzykoW przypadku definicji Brönsteda-Lowry wyjaśniono podstawowe zachowanie amoniaku w wodzie, ponieważ cząsteczka amoniaku NH3 Zaakceptuj jon h+ wody, a to zachowuje się jak Brönsted-Lowry Acid.
Reakcja amoniaku i wody w roztworze wodnym wynosi:
NH3 + H2Lub ⇔ nh4+ + Oh-
Podwójna strzałka oznacza, że reakcja jest odwracalna.
W ten sposób model Brönsted-Lowry uzupełnia twórcę Arrheniusa, w tym przypadki, które pierwotnie nie rozważały.
Substancje amfotencjalne
Woda zachowuje się jak kwas Brönsteda-Lowry'ego, gdy reaguje z roztworem amoniaku, ale jest również w stanie zachowywać się jako podstawa Brönsteda-Lowry, jak w następnej reakcji, między kwasem chlorowodorowym a wodą:
HCl + H2O → h3ALBO+ + Cl-
Gdy substancja ma podwójne zachowanie, to znaczy, może być kwasem lub zasadą według związku, z którym reaguje, nazywa się Amphothera.
Inne substancje amfotencjalne, oprócz wody, to jon wodorowęglanowy i aminokwasy.
Bibliografia
- Kwasy i zasady. Źródło: FQ.IESPM.Jest.
- Atkins, str. (2007). Zasady chemii. 3. Wydanie. Pan -american Medical Redaktorial.
- Chang, R. (2013). Chemia. 11va. Wydanie. McGraw Hill.
- Khan academy. Bronsted-Lowry Acids and Bases.
- Ripoll, e. Kwasy i zasady. Projekt Descartes. Źródło: ProjectOdescartes.org.

