Struktura chlorku żelaza (FECL2), używa, właściwości

- 3224
- 645
- Prokul Woliński
On Chlorek żelaza Jest to nieorganiczna substancja stała utworzona przez związek kationu wiary2+ i dwa aniony chlorkowe Cl-. Jego wzór chemiczny to FECL2. Ma tendencję do wchłaniania wody ze środowiska. Jednym z jego hydratów jest fecl tetrahydrat2 •4h2Lub która jest zielonkawą substancją stałą.
Podkreśla, że jest bardzo rozpuszczalny w wodzie i ma tendencję do łatwego utleniania się w obecności powietrza tworzącego żelazowy chlorek fecl3. Do łatwego utleniacza, a zatem zdolności do działania jako reduktor jest szeroko stosowany w laboratoriach badawczych chemicznych i biologicznych.
 Ferroso tetrahydrat chlorek fecl2 •4h2Lub solidne. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Ferroso tetrahydrat chlorek fecl2 •4h2Lub solidne. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Chlorek żelaza ma kilka zastosowań, które pomogą innym środkom w utlenianiu szlamu pochodzącego z oczyszczania ścieków lub ścieków. Jest również stosowany w procesie powlekania żelaza metalowego i ma pewne zastosowania w branży farmaceutycznej.
Zastosowanie FECL było również doświadczane2 W odzyskaniu cennych metali zużytych katalizatorów znalezionych w rurach wydechowych pojazdów, które pracują z benzyną lub olejem napędowym.
Jest używany w przemyśle tekstylnym do naprawy kolorów w niektórych rodzajach tkaniny.
[TOC]
Struktura
Chlorek żelazny powstaje przez jon wiary żelazny2+ i dwa jony chlorek Cl- Zjednoczone za pośrednictwem linków jonowych.
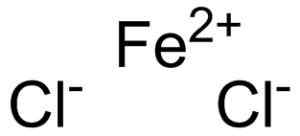 Ferroso Chloruro Fecl2 gdzie są jony, które to wymyślą. Epop [domena publiczna]. Źródło: Wikimedia Commons.
Ferroso Chloruro Fecl2 gdzie są jony, które to wymyślą. Epop [domena publiczna]. Źródło: Wikimedia Commons. Wiara żelazna2+ Ma następującą strukturę elektroniczną:
1s2, 2s2 2 p6, 3s2 3p6 3d6, 4s0
gdzie możesz zobaczyć, że straciłeś dwa elektronę warstwy 4S.
Ta konfiguracja nie jest bardzo stabilna i z tego powodu ma tendencję do utleniania, to znaczy utraty kolejnego elektronu, tym razem warstwy 3D, tworząc jon wiary3+.
Ze swojej części chlorek jonowy Cl- Ma następującą strukturę elektroniczną:
1s2, 2s2 2 p6, 3s2 3p6
gdzie możesz zobaczyć, że uzyskałeś dodatkowy elektron w warstwie 3P, uzupełniając go. Ta konfiguracja jest bardzo stabilna, ponieważ wszystkie warstwy elektroniczne są kompletne.
Nomenklatura
- Chlorek żelaza
- Chlorek żelaza (ii)
Może ci służyć: określenie popiołów: metody i przykłady- Żelazny dichlorek
- Tetrahydrat Ferrous Chlorek: FECL2 •4h2ALBO
Nieruchomości
Stan fizyczny
Kolorowy do jasnozielony, kryształy.
Waga molekularna
126,75 g/mol
Temperatura topnienia
674 ° C
Punkt wrzenia
1023 ° C
Dokładna waga
3,16 do 25 ºC/4 ºC
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 62,5 g/100 ml w 20 ° C. Rozpuszczalne w alkoholu, acetonie. Lekko rozpuszczalne w benzenu. Praktycznie nierozpuszczalne w eterze.
Inne właściwości
FECL2 bezwodne jest bardzo higroskopowe. Wchłaniaj wodę z łatwością środowiska, tworząc różnorodne hydraty, zwłaszcza tetrahydrat, w którym dla każdej cząsteczki FECL2 Istnieją 4 cząsteczki H2Lub powiązane z tym (FECL2 •4h2ALBO).
W obecności powietrza powoli utlenia się do FECL3. Oznacza to, że wiara jon2+ Łatwo utlenia wiarę jonową3+.
Jeśli nagrzejesz się w obecności szybkiego chlorku powietrznego FECL3 I Fe Tlenku żelaza2ALBO3.
FECL2 Jest żrący dla metali i tkanek.
Uzyskanie
Uzyskuje się go przez leczenie nadmiaru wiary żelaza wodnym roztworem kwasu chlorowodorowego HCl w wysokich temperaturach.
Wiara0 + 2 HCl → FECL2 + 2 godz+
Jednak ze względu na obecność wody za pomocą tej metody uzyskuje się chlorek tetrahydratu2 •4h2ALBO.
Aby uzyskać bezwodne (bez wody włączonej do kryształów) niektórzy badacze postanowili wykonać reakcję pyłu żelaza z wzgórzami bezwodnymi (bez wody) w rozpuszczalniku tetrahydrofuranowym (THF) w temperaturze 5 ° C.
Związek FECL jest uzyskiwany w ten sposób2 •1.5thf, które po ogrzewaniu w temperaturze 80-85 °2 bezwodny.
Aplikacje
Chlorek żelaza ma różne zastosowania w oparciu o jego pojemność zmniejszającą, to znaczy można go łatwo utlenić. Jest używany na przykład w obrazach i powłokach, ponieważ pomaga je naprawić z powierzchni.
Żelazo jest niezbędnym mikroelementem dla zdrowia ludzkiego i niektórych zwierząt. Jest zaangażowany w syntezę białek, oddychanie i mnożenie komórek.
Dlatego FECL2 Jest stosowany w preparatach farmaceutycznych. Ion wiary2+ Jako taki jest lepiej wchłonięty niż jon wiary3+ W jelicie.
Może ci służyć: węglan wapnia: struktura, właściwości, formacja, użyciaSłuży do produkcji FECL3. Jest stosowany w metalurgii, w powłokach żelaza, aby zapewnić bardziej plastyczny depozyt.
Oto inne wybitne zastosowania.
W zabarwieniu tkaniny
FECL2 Jest używany jako mordanta lub utrwalacza kolorowanki w niektórych rodzajach tkaniny. Mordant reaguje chemicznie i łączy się jednocześnie z barwnikiem i tkaniną tworzącym nierozpuszczalny związek.
W ten sposób barwnik jest przymocowany do tkaniny, a jego kolor nasila.
 Ferrous chlorek FECL2 Umożliwia ustalenie kolorów na tkaninach. Gina Pina [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons.
Ferrous chlorek FECL2 Umożliwia ustalenie kolorów na tkaninach. Gina Pina [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons. W oczyszczaniu ścieków
FECL2 Jest stosowany w ściekach lub oczyszczalni odpadów (wody kanalizacyjne).
W tym zastosowaniu chlorek żelaza uczestniczy w utlenianiu błota, poprzez proces zwany utlenianiem Fentona. To utlenianie powoduje pęknięcie kadłubów błotnych i pozwala na uwalnianie wody, która jest do tego silnie przymocowana.
 Część oczyszczalni ścieków, w której można zobaczyć błoto. Czasami jest to traktowane ferroso fecl chlorek2 aby można go było łatwiej oddzielić od wody. Evelyn Simak/Sewage Works na północ od Dickleburgh. Źródło: Wikimedia Commons.
Część oczyszczalni ścieków, w której można zobaczyć błoto. Czasami jest to traktowane ferroso fecl chlorek2 aby można go było łatwiej oddzielić od wody. Evelyn Simak/Sewage Works na północ od Dickleburgh. Źródło: Wikimedia Commons. Wtedy błoto może wyschnąć i odrzucić. Zastosowanie chlorku żelaznego pomaga obniżyć koszty procesu.
Niedawno zaproponowano również zmniejszenie tworzenia gazu siarczkowego lub siarkowodoru w wspomnianych kanałach ściekowych.
W ten sposób korozja wytwarzana przez ten gaz i nieprzyjemne zapachy zostałyby zmniejszone.
W badaniach chemicznych
Ze względu na jego właściwości redukujące (przeciwieństwo utleniania) FECL2 Jest szeroko stosowany w różnych badaniach chemii, fizyki i inżynierii.
Niektórzy naukowcy używali pary chlorku żelaza.
Te katalizatory są używane do wyeliminowania szkodliwych gazów dla ludzi i środowiska. Znajdują się w rurce ucieczki samochodów i ciężarówek, które pracują z benzyną lub olejem napędowym.
Może ci służyć: masa molowa: jak jest obliczana, przykłady i rozwiązane ćwiczenia Rurka wydechowa pojazdu, w którym obserwuje się bardziej obszerny przekrój, w którym znajduje się katalizator w celu przekształcenia szkodliwych gazów w przyjazne gazy w środowisku. Ahanix1989 w angielskiej Wikipedii [domena publiczna]. Źródło: Wikimedia Commons.
Rurka wydechowa pojazdu, w którym obserwuje się bardziej obszerny przekrój, w którym znajduje się katalizator w celu przekształcenia szkodliwych gazów w przyjazne gazy w środowisku. Ahanix1989 w angielskiej Wikipedii [domena publiczna]. Źródło: Wikimedia Commons. Po pewnym czasie katalizator pojazdu jest wydawany i traci skuteczność i musisz go wymienić. Zużyty katalizator jest odrzucony i podejmowane są wysiłki w celu odzyskania cennych metali, które zawiera.
 Ceramiczna siatka katalizatora, w której znajdują się ślady cennych metali do odzyskania z FECL2. Global-Kat Recycling [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Ceramiczna siatka katalizatora, w której znajdują się ślady cennych metali do odzyskania z FECL2. Global-Kat Recycling [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Według naukowców, z żelazem chlorku żelaza te metale tworzyły stopy magnetyczne.
Stopy można wyodrębnić magnesami, a następnie odzyskać cenne metale za pomocą znanych metod.
W badaniach biochemicznych
Za posiadanie kationu wiary2+, który jest ważnym mikroelementem w istocie człowieka i niektórych zwierząt, FECL2 Jest stosowany w badaniach biochemii i medycyny.
Niektóre badania pozwoliły na wykazanie, że chlorek żelaza poprawia skuteczność grzybobójczych w osoczu argonowym.
Zimna plazma to technologia stosowana do sterylizacji powierzchni medycznych i instrumentów. Opiera się na tworzeniu rodników hydroksylowych OH · z wilgotności środowiska. Te rodniki reagują ze ścianą komórkową mikroorganizmu i powodują ich śmierć.
W tym dochodzeniu FECL2 Wpływ zimnego osocza poprawił się i przyspieszył eliminację grzyba odpornego na inne metody dezynfekcji.
Niektórzy naukowcy odkryli, że użycie FECL2 Umożliwia zwiększenie wydajności reakcji uzyskiwania glukozy na podstawie bagasse z trzciny cukrowej.
W tym przypadku bycie wiarą2+ Niezbędna mikroement dla zdrowia ludzkiego, jego obecność w śladach w produkcie nie wpłynęłaby na człowieka.
Bibliografia
- Fukuda, s. i in. (2019). Chlorek żelaza i siarczan żelaza Poprawiają skuteczność grzybobójczy. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI odzyskało.Clm.Nih.Gov.
- Ismal, lub.I. i yildirim, l. (2019). Metalowe knebelsy i biomordyty. W wpływie i perspektywach zielonej chemii technologii tekstylnych. Rozdział 3, pp.57-82. Odzyskane z naukowym.com.
- Zhang, w. i in. (2019). Kataliza chlorku magnezu i chlorku żelowego do produkcji ksylo-oligosacharydów i glukozy z torbassy trzciny cukrowej. Bioresoral Technol 2019, 291: 121839. NCBI odzyskało.NLM.Nih.Gov.
- Zhou, x. i in. (2015). Rola rdzennego żelaza w poprawie odwodnienia osadu Ta peroksydacja. Raporty naukowe 5: 7516. NCBI odzyskało.NLM.Nih.Gov.
- Rathnayake, zm. i in. (2019). Kontrola siarkowodoru w kanałach poprzez katalizowanie reakcji tlenem. Nauka o całkowitym środowisku 689 (2019) 1192-1200. NCBI odzyskało.NLM.Nih.Gov.
- Taninouchi i. i Okabe, T.H. (2018). Odzyskiwanie metali grupy platynowej z zużytych katalizatorów przy użyciu leczenia pary chlorku żelaza. Metall and Materi Trans B (2018) 49: 1781. Link odzyskał.Skoczek.com.
- LUB.S. National Library of Medicine. (2019). Chlorek żelaza. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov.
- Aresta, m. i in. (1977). Żelazo (0) Utlenianie przez chlorek wodoru w tetrahydrofuranie: prosty sposób na bezwodne chlorek (II). Nieorganiczna chemia, t. 16, nie. 7, 1977. Odzyskane z pubów.ACS.org.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- « Historia i znaczenie flagi Portugalii (zmienione obrazy)
- Pochodzenie etyki chrześcijańskiej, podstawy, przedstawiciele »

