Właściwości chlorku ołowiu, struktura, używa

- 4159
- 1292
- Maksymilian Kępa
On Chlorek ołowiowy Jest to sól nieorganiczna, której wzorem chemicznym jest PBCLN, Gdzie n jest liczbą utleniania ołowiu. Tak więc, gdy ołów jest jak +2 lub +4, sól to PBCL2 lub PBCL4, odpowiednio. Dlatego istnieją dwa rodzaje chlorków dla tego metalu.
Z nich PBCL2 Jest najważniejszy i stabilny; podczas gdy PBCL4 jest niestabilny i jest mniej użyteczny. Pierwszy ma charakter jonowy, w którym kation Pb2+ generuje interakcje elektrostatyczne z anionem CL- zbudować sieć krystaliczną; A drugi jest kowalencyjny, z linkami PB-CL, pochodzącymi z tetrahedronu ołowiu i chloru.
 Wytrącone igły PBCL2. Źródło: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Wytrącone igły PBCL2. Źródło: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Inną różnicą między chlorkami ołowiu jest to, że PBCL2 Jest to solidne kryształy w kształcie białego szkła (obraz doskonały); podczas gdy PBCL4 Jest to żółtawy olej, który może krystalizować przy -15ºC. Wejście PBCL2 Jest bardziej estetyczny niż PBCL4.
Oprócz wyżej wymienionych, PBCL2 Występuje w naturze jako minerał Cotunite; podczas gdy PBCL4 Nie, ponieważ jest podatne na rozkład. Podczas gdy z PBCL4 Możesz zdobyć PBO2, PBCL2 Wypierają nieskończoną różnorodność związków organetalicznych.
[TOC]
Nieruchomości
Właściwości chlorku ołowiu zależą od istoty liczby utleniania ołowiu; Ponieważ chlor się nie zmienia, ale robi sposób, w jaki oddziałuje z ołowiem. Dlatego oba związki należy rozwiązać; Chlorek ołowiowy (ii) z jednej strony i chlorek ołowiowy (IV) z drugiej.
-Chlorek ołowiowy (ii)
Masa cząsteczkowa
278,10 g/mol.
Wygląd fizyczny
Białe kryształy z kształtami igłą.
Gęstość
5,85 g/ml.
Temperatura topnienia
501ºC.
Punkt wrzenia
950ºC.
Rozpuszczalność wody
10,8 g/l w 20ºC. Jest mało rozpuszczalny i woda musi zostać podgrzewana, aby można było rozwiązać znaczną ilość.
Może ci służyć: wodorotlenek niklu (ii): struktura, właściwości, zastosowania, ryzykoWspółczynnik załamania światła
2199.
Chlorek ołowiowy (IV)
Masa cząsteczkowa
349 012 g/mol.
Wygląd fizyczny
Żółta tłusta płyn.
Gęstość
3,2 g/ml.
Temperatura topnienia
-15ºC.
Punkt wrzenia
50ºC. W wyższych temperaturach rozkłada się, uwalniając gazowy chlor:
PBCL4(s) => PBCL2(s) + cl2(G)
W rzeczywistości ta reakcja może być bardzo wybuchowa, więc PBCL jest przechowywana4 W kwasie siarkowym w temperaturze -80ºC.
Struktura
-Chlorek ołowiowy (ii)
Na początku wspomniano, że PBCL2 Jest to związek jonowy, więc składa się z jonów PB2+ i Cl- które buduje kryształ, w którym ustalono stosunek PB: CL równy 1: 2; To znaczy, że są dwa razy i aniony cl- Jakie katacje pb2+.
W rezultacie powstają kryształy ortorekbiel.
 Struktura Cotunite. Źródło: Benjah-BMM27 [domena publiczna].
Struktura Cotunite. Źródło: Benjah-BMM27 [domena publiczna]. Ta struktura odpowiada również strukturze minerału Cotunit. Chociaż słupki są używane do wskazania kierunkowości łącza jonowego, nie należy go mylić z kowalencyjnym (lub przynajmniej czysto kowalencyjnym).
We wspomnianych kryształach ortorombowych PB2+ (Kule grilli) ma dziewięć CL- (zielone kule) otaczają go, jakby był zamknięty w trójkątnym pryzmat. Dla skomplikowanego struktury i niskiej gęstości jonowej Pb2+, Cząsteczki są trudne do rozwiązania szkła; powód, dla którego jest mało rozpuszczalny w zimnej wodzie.
Gaza cząsteczki fazowej
Gdy ani kryształ, ani ciecz nie mogą oprzeć się wysokim temperaturom, jony zaczynają odparować jako cząsteczki PBCL2 dyskretny; to znaczy z kowalencyjnymi wiązaniami CL-PB-CL i kątem 98º, jakby to był bumerang. Następnie mówi się, że faza gazowa składa się z tych cząsteczek PBCL2 i nie jonów przenoszonych przez prądy powietrzne.
Może ci służyć: elektroonycznośćChlorek ołowiowy (IV)
Tymczasem PBCL4 Jest to kowalencyjny związek. Ponieważ? Ponieważ kation Pb4+ Jest mniejszy, a także ma większą gęstość obciążenia jonowego niż PB2+, co powoduje większą polaryzację elektronicznej chmury CL-. W rezultacie zamiast interakcji typu jonowego Pb4+Cl-, Powstaje kowalencyjny link PB-CL.
Biorąc to pod uwagę, rozumiane jest podobieństwo między PBCL4 I na przykład CCL4; Oba są przedstawiane jako czworościenne indywidualne cząsteczki. W ten sposób wyjaśniono, dlaczego ten chlorek ołowiu jest żółtawym olejem w normalnych warunkach; Atomy CL są kilkoma powiązanymi ze sobą i „poślizgnięciem się”, gdy dwie cząsteczki PBCL4 Cieszą się.
Jednak gdy temperatura opada, a cząsteczki stają się wolniejsze, prawdopodobieństwo i skutki natychmiastowych dipoli są zwiększone (PBCL4 Jest to apolarne, biorąc pod uwagę jego symetrię); A potem olej zamarza jako żółte kryształy sześciokątne:
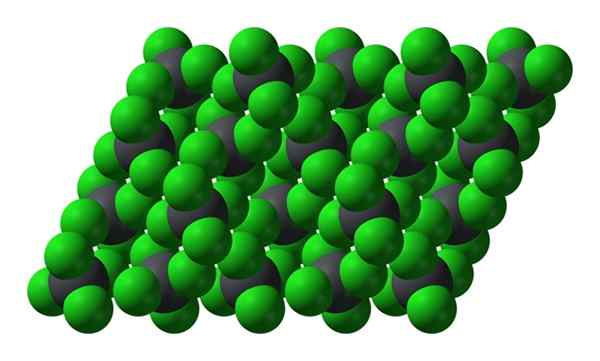 Krystaliczna struktura PBCL4. Źródło: Benjah-BMM27 [domena publiczna]
Krystaliczna struktura PBCL4. Źródło: Benjah-BMM27 [domena publiczna] Zwróć uwagę, że każda szarawna kula jest otoczona czterema zielonymi kulami. Te cząsteczki PBCL4 „Sueped” tworzy niestabilny kryształ i podatny na energiczne rozkładanie się.
Nomenklatura
Nazwy: chlorek ołowiowy (ii) i chlorek ołowiowy (iv) odpowiadają tym przypisanym zgodnie z nomenklaturą zapasową. Ponieważ numer utleniania +2 jest najmniejszy dla ołowiu, a +4 największy, oba chlorki można nazwać tradycyjną nomenklaturą jako chlorek hydrauliczny (PBCL2) i chlorek plúbiczny (PBCL4) odpowiednio.
I wreszcie jest systematyczna nomenklatura, która podkreśla liczbę każdego atomu związku. Zatem PBCL2 Jest to dichlorek ołowiowy i PBCL4 Tetrachlor ołowiowy.
Może ci służyć: nieprzenikniność chemicznaAplikacje
Praktyczne zastosowanie PBCL nie jest znane4 Oprócz obsługi syntezy PBO2. Jednak PBCL2 Jest bardziej przydatny i dlatego tylko niektóre zastosowania tego konkretnego chlorku ołowiu zostaną wymienione poniżej:
- Ze względu na swoją wysoce luminescencyjną naturę jest przeznaczony do detektorów fotograficznych, akustycznych, optycznych i promieniowych.
- Nie wchłaniając się w obszarze widma podczerwieni, jest stosowany do produkcji szkła, który przenosi ten rodzaj promieniowania.
- Był częścią tego, co nazywają szkłem aureno, atrakcyjnym materiałem opalizujących niebieskawe zabarwienie używane do celów ozdobnych.
- Ponadto, podążając za tematem sztuki, kiedy się osiągniesz, PBCL2· PB (OH)2 nabywa intensywne białawe odcienie, używając białego pigmentu ołowiu. Jednak jego stosowanie zostało zniechęcone ze względu na wysoką toksyczność.
- Stopione i zmieszane z tytanianem baru, Batio3, Pochodzi ceramika Titanato baru i ołowiu1 -xPbXWujek3. Jeśli Pb2+ Wprowadź Batio3, BA2+ Musisz opuścić szkło, aby pozwolić na jego włączenie, a następnie mówi się, że następuje wymiana kationowa; Dlatego skład BA2+ Jest wyrażany jako 1-x.
- I wreszcie z PBCL2 Kilka związków organetalicznych o ogólnym wzorze rumula jest syntetyzowane r4Pb lub r3PB-PBR3.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Ołów (ii) chlorek. Źródło: w:.Wikipedia.org
- Preparat chemiczny. (2019). Chlorek ołowiowy (IV). Odzyskane z: preparat quimica.com
- Clark Jim. (2015). Chlorki węgla, krzemu i ołowiu. Odzyskane z: chemguide.współ.Wielka Brytania
- Badania spektralne i optyczne nieliniowe na chlorku ołowiu (PBCL2) Kryształy. [PDF]. Odzyskany z: Shodhganga.Infibnet.AC.W
- National Center for Biotechnology Information. (2019). Chlorek ołowiowy. Baza danych Pubchem; CID = 24459. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- « Właściwości chlorku manganu, struktura, zastosowania, ryzyko
- Koszt konwersji Jak obliczone i przykłady »

