Właściwości chlorku manganu, struktura, zastosowania, ryzyko

- 4611
- 990
- Pani Waleria Marek
On Chlorek manganu Jest to sól nieorganiczna, której wzorem chemicznym jest MCL2. Składa się z jonów MN2+ i Cl- w stosunku 1: 2; Dla każdego kationu MN2+ Jest dwa razy z anionów CL-.
Ta sól może tworzyć kilka hydratów: MNCL2· 2H2Lub, (dihydrate), MCL2· 4H2Lub (tetrahydrat) i MCL2· 6H2Lub (sześciokadrat) Najczęstszą formą soli jest czterosłyn.
 Różowe kryształy chlorku manganu. Źródło: Ondřej Mang [domena publiczna]
Różowe kryształy chlorku manganu. Źródło: Ondřej Mang [domena publiczna] Na fizyczne właściwości chlorku manganu, takie jak gęstość, punkt topnienia i rozpuszczalność w wodzie, wpływa ich stopień nawodnienia. Na przykład temperatura topnienia postaci bezwodności jest znacznie większa niż w formie tetrahydratu.
Kolor chlorku manganu jest jasnoróżowy (doskonały obraz). Badość jest charakterystyczna dla soli metali przejściowych. Chlorek manganu jest słabym kwasem Lewis.
Minerał znany jako Escacquita jest naturalną bezwodną formą chlorku manganu (II); Jak Kempita.
Chlorek manganu (II) jest używany jako środek stopowy; Katalizator w reakcjach chlorowania itp.
[TOC]
Właściwości fizyczne
Wygląd fizyczny
- Forma anhydra: różowe kryształy sześcienne.
- Forma tetrahydratu: nieco delikatne czerwone kryształy monokliniczne.
Masy molowe
- Anhidro: 125 838 g/mol.
- Dihydrain: 161,874 g/mol.
- Tetrahydrat: 197,91 g/mol.
Punkty fuzji
- Anhidro: 654 ºC.
- Dihydrain: 135 ° C.
- Tetrahydrat: 58 ° C.
Punkt wrzenia
Forma anhidra: 1.190 ° C.
Gęstości
- Bezhodny: 2977 g/cm3.
- Dihydrain: 2,27 g/cm3.
- Tetrahydrat: 2,01 g/cm3.
Rozpuszczalność wody
Forma anhydra: 63,4 g/100 ml w 0 ° C; 73,9 g/100 ml w 20 ° C; 88,5 g/100 ml w 40 ° C; i 123,8 g/100 ml w 100 ° C.
Rozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalne w pirydynie i etanolu, nierozpuszczalnym w eterze.
Rozkład
O ile nie są podejmowane należytą środki ostrożności, odwodnienie nawodnionych kształtów w postaci bezwodnej może powodować odwodnienie hydrolityczne, z wytwarzaniem chlorku wodoru i oksychlorku manganu.
Ph
0,2 M roztwór tetrahydratu chlorku manganu w roztworze wodnym ma pH 5,5.
Może ci służyć: chromatogramStabilność
Jest stabilny, ale wrażliwy na wilgoć i niekompatybilny z silnymi kwasami, metaliami reaktywnymi i nadtlenkiem wodoru.
Struktura chlorku manganu
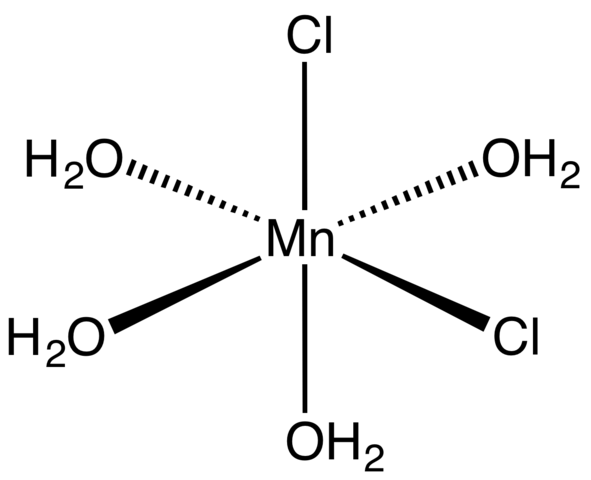 Kompleks koordynacyjny dla tetrahydratu MNCL2. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Kompleks koordynacyjny dla tetrahydratu MNCL2. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Począwszy od soli tetrahydratowej, różowych i uderzających kryształów, musi składać się z kompleksów koordynacyjnych (obraz doskonały). W nich MN Metallic Center2+ jest otoczony oktaczówką zdefiniowaną czterema cząsteczkami H2Lub i dwa aniony CL-.
Zauważ, że ligands CL- Są w pozycjach CIS; Wszystkie są równoważne w prostokątnej podstawie Octaedro i nie ma znaczenia, czy CL jest „poruszony”- do któregokolwiek z pozostałych trzech pozycji. Kolejnym możliwym izomerem dla tej skoordynowanej cząsteczki, w której zarówno Cl- Są w pozycjach trans; to znaczy na różnych końcach (jeden powyżej i drugi poniżej).
Cztery cząsteczki wody z mostami wodorowymi pozwalają przyłączyć się do dwóch lub więcej oktahedr. Te mosty są wysoce kierunkowe i dodając interakcje elektrostatyczne między MN2+ i Cl-, Ustanawiają uporządkowaną strukturę charakterystyczną dla kryształu.
Różowy kolor MNCL2· 4H2Lub jest spowodowane elektronicznymi przejściami MN2+ i jego konfiguracja D5. Podobnie zaburzenia spowodowane w pobliżu cząsteczek wody i chlorki modyfikują niezbędną ilość energii, którą takie elektrony muszą wchłonąć5 Podróżować wyższymi poziomami energii.
Dihydrat
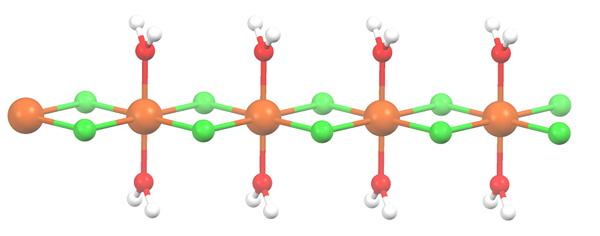 Struktura polimerowa dla MNCL2 · 2H2O. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Struktura polimerowa dla MNCL2 · 2H2O. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Sól odwodniła się, a jej formuła staje się teraz MCL2· 2H2ALBO. Co dzieje się z przednim oktaczronem? Nic, z wyjątkiem tego, że dwie cząsteczki H2Lub że porzuceni są zastąpione dwoma CL-.
Na początku możesz sprawić niewłaściwe wrażenie, że są cztery Cl- na każdy MN2+; Jednak połowa oktaedronów (osiowo) jest w rzeczywistości powtarzającą się jednostką szkła.
Zatem prawdą jest, że istnieje Mn2+ skoordynowane w dwóch Cl- i dwie cząsteczki wody w pozycjach trans. Ale aby ta jednostka mogła interakcja z inną, potrzebuje dwóch mostów CL, co z kolei pozwala na zakończenie oktaedronu koordynacji manganu.
Może ci służyć: elementy diatomoweOprócz mostów CL, cząsteczki wody również współpracują z ich mostami wodorowymi, dzięki czemu ten łańcuch MNCL2· 2H2Lub nie rozbrojeni.
Bezwodny
Wreszcie, chlorek magnezu zakończył utratę całej wody zawartej w jej kryształach; Masz teraz sól anhydry, MCL2. Bez cząsteczek wody kryształy znacznie tracą intensywność swoich różowych kolorów. Octahedron, jak w przypadku hydratów, pozostaje niezmieniony przez samą naturę manganu.
Bez cząsteczek wody, MN2+ końce otoczone oktaczoniem skomponowanym tylko z CL-. Ten link koordynacyjny ma zarówno charakter kowalencyjny, jak i jonowy; Z tego powodu zwykle odnosi się to do struktury MNCL2 jak kryształ polimerowy. W nim znajdują się alternatywne warstwy Mn i Cl.
Nomenklatura
Mangan ma wiele możliwych stanów utleniania. Z tego powodu tradycyjna nomenklatura dla MNCL2 Nie jest to wyjaśnione.
Z drugiej strony chlorek manganu odpowiada jego najbardziej znanej nazwie, do której nie miałby dodać „(ii)”, aby było to zgodnie z akcją nomenklatury: chlorek manganu (ii). A asçi jest systematyczną nomenklaturą: dichlorek manganu.
Aplikacje
Laboratorium
Chlorek manganu służy jako katalizator chlorowania związków organicznych.
Przemysł
Chlorek manganu jest wykorzystywany jako surowiec do opracowania anty -artysantes dla benzyny; materiał spawalniczy dla metali nieżelaznych; pośrednik w opracowywaniu pigmentów; I napój olejowy Linaza.
Jest używany w przemyśle tekstylnym do drukowania i farbowania; w produkcji kilku soli manganu, w tym trikarbonilu metylokklączowego mangiangańskiego stosowanego jako barwnik cegły; oraz w produkcji suszonych baterii elektrycznych.
Chlorek manganu jest stosowany jako środek stopowy i jest dodawany do stopionego magnezu w celu wytwarzania stopów manganu-magnezji; jako pośrednik w przygotowaniu środków suszenia do malowania i lakieru; i jako składnik środków dezynfekujących.
Może ci służyć: wodorotlenek sodu (NaOH): struktura, właściwości, zastosowania, syntezaJest również stosowany w oczyszczaniu magnezu.
Nawóz i karma dla zwierząt
Chlorek manganu jest stosowany jako źródło manganu, pierwiastka, który, choć nie podstawowy element odżywczy dla roślin takich jak azot, fosfor i potas, stosuje się w licznych reakcjach biochemicznych tych żywych istot tych żywych istot.
Zwiększa także paszę zwierząt hodowlanych w celu dostawy manganu, niezbędnego oligoementu dla wzrostu zwierząt.
Chlorek manganu jest składnikiem dietetycznym, który dostarcza mangan, element, który interweniuje w wielu procesach niezbędnych do życia, w tym: syntezę kwasów tłuszczowych i hormonów płciowych; asymilacja witaminy E; Produkcja chrząstki; itp.
Ryzyko
Może wytwarzać poprzez kontakt z zaczerwienieniem skóry, podrażnieniem i przedłużonym zapaleniem skóry narażenia. Chlorek manganu powoduje zaczerwienienie, ból i łza.
Przez wdychanie przyczyna soli, ból gardła i brak oddechu. Z drugiej strony spożycie może wystąpić wymioty, nudności i biegunki.
Nadmierne przewlekłe wdychanie tej soli może prowadzić do zapalenia płuc, a następnie reaktywnej choroby dróg oddechowych.
Jego nadmierne spożycie może powodować zaburzenia psychiczne, odwodnienie, niedociśnienie, niewydolność wątroby i nerki, niewydolność układu wielorasowego i śmierć.
Neurotoksyczność jest początkowym przejawem niepożądanego działania manganu, możliwości przedstawienia bólów głowy, zawrotów głowy, utraty pamięci, hiperrefleksji i łagodnego drżenia.
Ciężka toksyczność objawia się objawami i oznakami podobnymi do obserwowanych w chorobie Parkinsona.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Chlorek manganu (ii). Źródło: w:.Wikipedia.org
- Nanomateriały nieba. (2016). Mangan chlorkowy proszek. Odzyskane z: ssnano.com
- Książka chemiczna. (2017). Chlorek mangan. Odzyskany z: chemicalbook.com
- Sieć danych toksykologii. (S.F.). Chlorek mangan. Toxnet. Odzyskane z: toksnet.NLM.Nih.Gov
- Gérard Cahiez. (2001). Chlorek manganu (ii). doi.Org/10.1002/047084289X.RM020
- National Center for Biotechnology Information. (2019). Dichlorek manganu. Baza danych Pubchem. CID = 24480. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Webconsultas Healthcare, s.DO. (2019). Minerały: mangan. Odzyskane z: konsultacje internetowe.com

