Chlorek strontu (SRCL2)
- 1826
- 366
- Filip Augustyn
Co to jest chlorek strontu?
On Chlorek strontu Jest to związek nieorganiczny utworzony przez Strontium, metal alkaliczne (SR. Becamgbara) i chlor halogenowy. Ponieważ oba pierwiastki mają bardzo różne elektrowni, związek jest jonowym stałą, której wzorem chemicznym jest SRCL2.
Jak jonowe stałe, składa się z jonów. W przypadku SRCL2, Są kationą SR2+ Na każde dwa aniony cl-. Jego właściwości i zastosowania są podobne do chlorku wapnia i baru.
Jak chlorek wapnia (CACL2), jest higroskopijny, a jego kryształy pochłania wodę z tworzeniem soli heksahydratu, w której sześć cząsteczek wody występuje w krystalicznej sieci (SRCL2· 6H2ALBO). W rzeczywistości dostępność hydratu jest większa niż SRCL2 bezwodne (bez wody).
Jednym z jego głównych zastosowań jest prekursor innych związków strontu; Oznacza to, że stanowi źródło strontu w pewnej syntezy chemicznej.
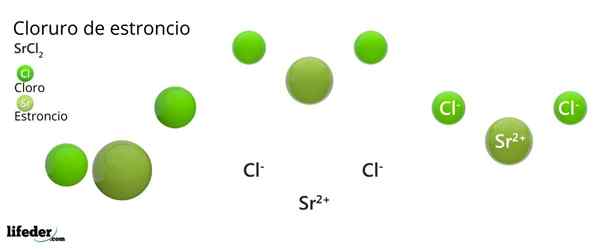
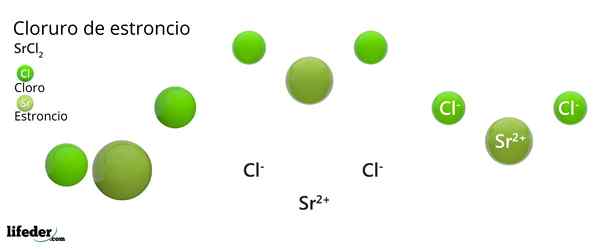
Struktura chlorku strontu
 Krystaliczna struktura chlorku strontu
Krystaliczna struktura chlorku strontu Najwyższy obraz reprezentuje typ struktury krystalicznej zdeformowany SRCL2 bezwodny. W tym małe zielone kule odpowiadają jonom SR2+, Podczas gdy obszerne zielone kule reprezentują jony CL-.
W tej strukturze każda sr2+ Jest „uwięziony” przez osiem jonów CL-, W konsekwencji posiadanie liczby koordynacji równej 8 i być może wokół niego geometrii sześciennej. To znaczy, cztery zielone kule tworzą dach kostki, podczas gdy pozostałe cztery podłogę zlokalizowały SR2+ W środku.
Jaka byłaby struktura fazowa sody? Struktura Lewisa dla tej soli jest CL-SR-CL, najwyraźniej liniowa i zakłada sto procent jego linków. Jednak w fazie gazowej -SRCL2(g)- Ta „linia” pokazuje kąt około 130 °, w rzeczywistości jest to rodzaj v.
Może ci służyć: stan gazowy: cechy, prawo ogólne, przykładyNie można było pomyślnie wyjaśnić anomalii, biorąc pod uwagę fakt, że stront nie ma elektronów, które zajmują objętość elektroniczną. Być może może to być spowodowane udziałem orbity d w linkach lub z zakłóceniem rdzenia elektronu.
Używa/zastosowania chlorku strontu
SRCL2· 6H2Lub był używany jako addytywny w polimerach organicznych; Na przykład w alkoholu poliwinylowym w celu zmodyfikowania jego właściwości mechanicznych i elektrycznych.
Jest stosowany jako ferryt strontu w produkcji magnesów ceramicznych i szklanych przeznaczonych do tworzenia kryształu przednich telewizyjnych.
Reaguje z chromatem sodu (na2CRO4) w celu wytworzenia chromianu strontu (srcro4), która jest stosowana jako farba odporna na korozję do aluminium.
Kiedy są ogrzewane ogniem, związki strontu świecą czerwonawym płomieniem, dlatego są przeznaczone do opracowania rozbłysków i fajerwerków.
Zastosowania lecznicze
Radioizotop chlorku strontu 89 (najliczniejszym izotopem jest 85Pan.
Zastosowanie rozcieńczonych roztworów (3-5 %) przez ponad dwa tygodnie w leczeniu alergicznego nieżytu nosa (przewlekłe zapalenie błony śluzowej nosa), wykazuje poprawę zmniejszania kichania i wcierania nosa.
Po zastosowaniu w preparatach pasty zębowej w celu zmniejszenia wrażliwości zębów, tworząc barierę na mikrotubulach zębowych.
Badania tego związku wykazują skuteczność terapeutyczną w porównaniu z prednizolonem (metabolit leku prednizonu) w leczeniu wrzodziejącego zapalenia jelita grubego.
Może ci służyć: ułamek molowy: jak jest obliczany, przykłady, ćwiczeniaJego wyniki oparte są na modelu szczurów; Mimo to stanowi nadzieję dla pacjentów, którzy również cierpią na osteoporozę, ponieważ mogą przejść do tego samego leku, aby zwalczyć te dwie choroby.
Służy do syntezy siarczanu strontu (SRSO4), jeszcze bardziej gęstsze niż SRCL2. Jednak jego minimalna rozpuszczalność wody nie sprawia, że jest wystarczająco lekka, aby można go było zastosować w radiologii, w przeciwieństwie do siarczanu baru (Baso4).
Przygotowanie chlorku strontu
Chlorek strontu można przygotować przez bezpośrednie działanie kwasu solnego (HCL) na czystym metalu, występując w ten sposób reakcję typu redoks:
MR (S) + HCl (AC) => SRCL2(AC) + H2(G)
Tutaj metal strontu jest utleniany przez przekazanie dwóch elektronów, aby umożliwić tworzenie się wodoru gazowego.
Również węglan wodorotlenkowy i strontu (SR (OH)2 i SRCO3) reaguj z tym kwasem, syntetyzując go:
SR (OH)2(s) + 2HCl (ac) => srcl2(AC) + 2H2Lub (l)
SRCO3(s) + 2HCl (ac) => srcl2(AC) + CO2(g) + h2Lub (l)
Stosując techniki krystalizacji, uzyskuje się SRCL2· 6H2ALBO. Po odwodnionym działaniu termicznym, dopóki SRCL w końcu nie wytworzy2 bezwodny.
Właściwości chlorków strontu
Właściwości fizyczne i chemiczne tego związku zależą od tego, czy jest on w postaci uwodnionej czy bezwodnej. Wynika to z faktu, że interakcje elektrostatyczne zmieniają się w miarę dodawania cząsteczek wody do krystalicznej sieci SRCL2.
Bezwodny
Chlorek strontu jest białym krystalicznym stałym, o masie cząsteczkowej 158,53 g/mol i gęstości 3,05 g/ml.
Jego temperatury topnienia (874 ° C) i gotowanie (1250 °2+ i Cl-. Odzwierciedla także wielką krystaliczną energię siatkową, którą ma jej bezwodna struktura.
Może ci służyć: octan celulozyEntalpia formacji SRCL2 Solid wynosi 828,85 kJ/mol. Odnosi się to do energii cieplnej uwalnianej przez każdy kret utworzony z jego składników w standardowych stanach: chlor i gaz stały dla strontu.
Heksahydrat
W postaci heksahydratu ma on wyższą masę cząsteczkową niż jego kształt bezwodny (267 g/mol) i niższą gęstość (1,96 g/ml). Ten spadek jego gęstości wynika z faktu, że cząsteczki wody „rozszerzają” kryształy, zwiększając objętość; Dlatego gęstość struktury maleje.
Jest prawie dwa razy gęsty niż woda w temperaturze pokojowej. Jego rozpuszczalność w wodzie jest bardzo wysoka, ale w etanolu jest lekko rozpuszczalny. Wynika to z jego organicznego charakteru pomimo jego polaryzacji. To znaczy, hexahydrat jest nieorganicznym związkiem polarnym. Wreszcie, w 150 °
Srcl2· 6H2Lub (s) => srcl2(s) + 6h2O (g)
Bibliografia
- Wikipedia. (2018). Chlorek strontu. Odzyskane z.Wikipedia.org
- Bank narkotykowy. (2018). Chlorek strontu SR-89. Drugbank wyzdrowiał.AC
- Pubchem. (2018). Chlorek strontu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov
- Byk. Mater. (2010). Wpływ ziarnistego chlorku stanu jako dodatki na właściwości elektryczne i mechaniczne podwodne dla czystego alkoholu poliwinylowego. Sci., Tom. 33, nie. 2, pp. 149-155. Indian Academy of Sciences.
- CCOIL. (4 września 2009). Stontium-chlorek -xtal-3D-SF. [Postać]. Pobrano 13 kwietnia 2018 r. Z: Commons.Wikimedia.org
- Wszystkie reakcje. SRCL2 - chlorek Stontium. Odzyskane z reakcji allreakcji.com