Difenyloamina
- 2353
- 506
- Matylda Duda
Co to jest defilamina?
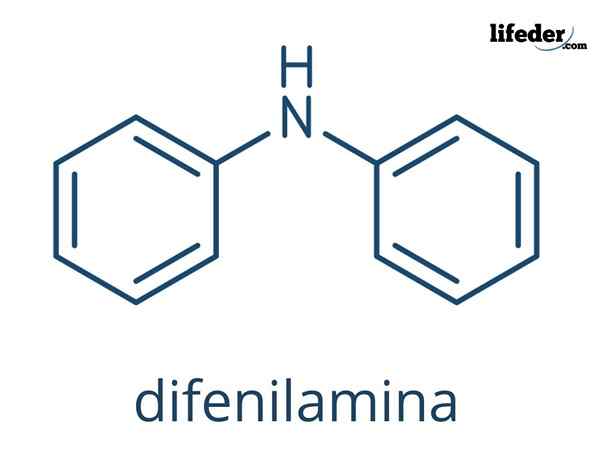
Difenyloamina Jest to związek organiczny, którego wzór chemiczny jest (c6H5)2NH. Jego nazwa wskazuje, że jest to amina, a także jej formuła (-NH2). Z drugiej strony termin „różnorodny” odnosi się do obecności dwóch pierścieni aromatycznych związanych z azotem. W związku z tym defilamina jest aromatyczną aminą.
W świecie związków organicznych aromatyczne słowo niekoniecznie jest związane z istnieniem jego zapachów, ale z cechami, które określają ich zachowania chemiczne wobec niektórych gatunków.

W przypadku difenyloaminy jej aromatyczność i fakt, że ich stała przedstawia charakterystyczny aromat. Jednak fundament lub mechanizmy regulujące jego reakcje chemiczne można wytłumaczyć jego aromatycznym charakterem, ale nie ze względu na przyjemny aromat.
Jego struktura chemiczna, zasadowość, aromatyczność i interakcje międzycząsteczkowe są zmiennymi odpowiedzialnymi za jej właściwości: od koloru jego kryształów do zastosowania jako środek przeciwutleniający.
Struktura chemiczna defilaminy

Na obrazach wyższych reprezentowane są struktury chemiczne dyfeniaminy. Czarne kule odpowiadają atomom węgla, białym do atomów wodoru i niebieskiego atomu azotu.
Różnica między obiema obrazami jest modelem tego, jak reprezentują cząsteczkę graficznie. W niższym poziomie podkreśla aromatyczność pierścieni z liniami rozsianymi na czarno, a także płaska geometria tych pierścieni jest udowodniona.
Żaden z dwóch obrazów nie pokazuje samotnej parę elektronów nie udostępnianych atomem azotu. Te elektrony „przechodzą” przez sprzężony układ π podwójnych wiązań w pierścieniu. Ten system tworzy rodzaj krążącej chmury, która umożliwia interakcje międzycząsteczkowe; to znaczy z innymi pierścieniami z innej cząsteczki.
Może ci służyć: termometr laboratoryjny: Charakterystyka, do czego służy, przykładyPowyższe oznacza, że niepohamowany moment obrotowy azotu przechodzi przez oba pierścienie, rozkładając w tych gęstości elektronicznej, a następnie wracają do azotu, aby powtórzyć cykl ponownie.
W tym procesie dostępność tych elektronów maleje, co powoduje zmniejszenie zasadniczności dipelaminy (jej tendencja do przekazywania elektronów jako podstawy Lewisa).
Dipenyloamina używa/aplikacji
Difenyloamina jest środkiem utleniającym zdolnym do spełnienia serii funkcji, a wśród nich są następujące:
- Podczas przechowywania jabłka i gruszki doświadczają procesu fizjologicznego o nazwie Scalding, związany z produkcją sprzężonych Trienos, co prowadzi do uszkodzenia skóry owoców. Działanie diodyloaminy pozwala na zwiększenie okresu przechowywania, zmniejszając uszkodzenie owoców o 10 % tego, co jest obserwowane przy ich nieobecności.
- Podczas walki z utlenianiem difenyloamina i jej pochodne rozszerzają funkcjonowanie silników, unikając pogrubienia zużytego oleju.
- Difenyloamina służy do ograniczenia działania ozonu w produkcji gumy.
- Difenyloamina jest stosowana w chemii analitycznej do wykrywania azotanów (no3-), Chlorany (Clo3-) i inne środki utleniające.
- Jest to wskaźnik stosowany w testach wykrywania zatrucia azotan.
- Gdy RNA jest hydrolizowany przez godzinę, reaguje z defilaminą; To pozwala na jego kwantyfikację.
- W medycynie weterynaryjnej Dipe -pulaminę jest używana miejscowo w zapobieganiu i leczeniu objawów robaka piorgidowego u zwierząt hodowlanych.
- Niektóre z pochodnych pojedynków należą do kategorii niesteroidowych leków przeciwzapalnych. Mogą również mieć efekty farmakologiczne i terapeutyczne, takie jak przeciwdrobnoustrojowe, przeciwbólowe, przeciwdrgawki i aktywność przeciwnowotworowa.
Przygotowanie diodyloaminy
Oczywiście defilamina jest wytwarzana w cebuli, w kolentr, w liściach zielonej i czarnej herbaty oraz w skorupach owoców cytrusowych. Syntetycznie istnieje wiele dróg, które prowadzą do tego związku, takich jak:
Deaminacja termiczna anilin
Jest przygotowywany przez deaminację termiczną aniliny (c6H5NH2) W obecności katalizatorów utleniających.
Jeśli anilinę w tej reakcji nie zawiera atomu tlenu do jego struktury, dlaczego utleniasz? Ponieważ pierścień aromatyczny jest grupą atraktorów elektronów, w przeciwieństwie do atomu H, który przekazuje jego niską gęstość azotu elektronicznego w cząsteczce.
2 c6H5NH2 => (C5H5)2 NH+NH3
Również anilinę może reagować z solą chlorowodorku anilinowym (c6H5NH3+Cl-) pod ogrzewaniem 230 ° C przez dwadzieścia godzin.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Reakcja fenotiazyny
Dideniloamina pochodzi z kilku pochodnych w połączeniu z różnymi odczynnikami. Jedną z nich jest fenotiazyna, która synteza z siarką jest prekursorem pochodnych z działaniem farmaceutycznym.
(C6H5)2NH +2S => s (c6H4) NH +H2S

Właściwości diodyloaminy
Difenyloamina jest białą krystaliczną substancją stałą, która w zależności od jej zanieczyszczeń może zdobyć tony rozdzielcze, bursztynowe lub żółte. Ma przyjemny aromat kwiatowy, ma masę cząsteczkową 169,23 g/mol i gęstość 1,2 g/ml.
Cząsteczki tych ciał stałych oddziałują przez siły van der Waalsa, wśród których są mosty wodorowe utworzone przez atomy azotu (NH-NH) i układanie pierścieni aromatycznych, spoczywając ich „chmury elektroniczne” na drugiej.
Może ci służyć: siarczek cynkowy (ZNS)Ponieważ aromatyczne pierścienie dużo zajmują. Powyższe powoduje, że substancja stała nie ma bardzo wysokiego punktu fuzji (53 ° C).
Jednak w stanie ciekłym cząsteczki są bardziej oddzielne, a skuteczność mostów wodorowych poprawia się. Podobnie defilamina jest stosunkowo ciężka, wymaga dużej ilości ciepła, aby przejść do fazy gazowej (302 ° C, jej temperatura wrzenia). Wynika to również częściowo z wagi i interakcji pierścieni aromatycznych.
Rozpuszczalność i podstawa
Jest bardzo nierozpuszczalny w wodzie (0,03 g/100 g wody) ze względu na hydrofobowy charakter jej aromatycznych pierścieni. Zamiast tego jest bardzo rozpuszczalny w rozpuszczalnikach organicznych, takich jak benzen, tetrachlor węglowy (CCL4), aceton, etanol, pirydyna, kwas octowy itp.
Jego stała kwasowości (PKA) wynosi 0,79, co odnosi się do kwasowości jego sprzężonego kwasu (c6H5NH3+). Proton dodany do azotu ma tendencję do części, ponieważ para elektronów, z którymi jest połączony, może przejść przez pierścienie aromatyczne. Zatem wysoka niestabilność c6H5NH3+ Odzwierciedla niską zasadowość dyfunaminy.
Bibliografia
- Corporation Lubrizol. (2018). Przeciwutleniacze difenyloaminy. Odzyskane z smarzolu.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Farmakologiczne zastosowania difenyloaminy i jej pochodnej jako silny związek bioaktywny: przegląd. Obecne związki bioaktywne, tom 13.
- PrepChem. (2015-2016). Przygotowanie difenyloaminy. Odzyskane z PrepChem.com
- Pubchem. (2018). Difenyloamina. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Wikipedia. (2018). Difenyloamina. Odzyskane z.Wikipedia.org

