Permanganan potasu (KMNO4)

- 826
- 231
- Matylda Duda
 Kryształy nadmanganianu potasu
Kryształy nadmanganianu potasu Co to jest nadmanganian potasu?
On nadmanganian potasu (Kmno4) Jest to związek nieorganiczny utworzony przez metal -mangan -transujący grupa 7 (VIIB) -, tlen i potas. Jest to ciemna fioletowa szklanka. Jego wodne roztwory są również ciemne purpurowe; Rozwiązania te stają się mniej fioletowe, ponieważ są rozcieńczone w głównych ilościach wody.
Komercyjnie osiąga się w prezentacjach tabletek, kryształów i pyłu. Znany jest z imionami Condy lub Mineral Camaleón. Termin „kameleon” nawiązuje do zdolności minerału: jeśli zmienia kolor w kontakcie z sodą kaustyczną i materią organiczną, pojawia się cukier.
Kmno4 Zaczyna cierpieć redukcje (zysku elektrony) w kolejnej kolejności kolorów: fiolet> niebieski> zielony> żółty> bezbarwny (z brązowym brązowym MNO2). Ta reakcja pokazuje ważną właściwość permangananu potasu: jest to bardzo silny środek utleniający.
Formuła
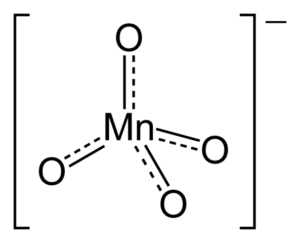
Jego formuła chemiczna to kmno4; to znaczy dla każdego kationu k+ Jest anion mno4- interakcja z tym
Struktura chemiczna potasu nadmanganianu
 Krystaliczna struktura KMNO4
Krystaliczna struktura KMNO4 Na górnym obrazie reprezentowana jest krystaliczna struktura KMNO4, który jest typem ortorrombicznym. Fioletowe kule odpowiadają Kacji K+, podczas gdy czworościan utworzony przez cztery czerwone kule i niebieskawa kula odpowiada anionowi MNO4-.
Dlaczego anion ma geometrię czworościenną? Jego struktura Lewisa odpowiada na to pytanie. Linie kropkowane oznaczają, że podwójne łącza rezonują między MN i O. Aby przyjąć tę strukturę, centrum metalowe musi mieć hybrydyzację sp3.

Ponieważ mangan nie ma niezwykłych par elektronów, wiązania Mn-O nie są pchane w kierunku tej samej płaszczyzny. Podobnie obciążenie ujemne jest rozmieszczone między czterema atomami tlenu, odpowiedzialny za orientację Kacji+ W ramach krystalicznych układów.
Może ci służyć: stała jonizacjiKMNO używa4
Medycyna i weterynaryjne
Ze względu na działanie bakteriobójcze jest stosowany w licznych chorobach i warunkach, które powodują zmiany skóry, takie jak: infekcje stóp grzybami, impetigo, powierzchowne rany, zapalenie skóry i wrzody tropikalne.
Ze względu na jego szkodliwe działanie permanganian potasu należy stosować w niskich stężeniach (1: 10000), co ogranicza skuteczność jego działania.
Jest również stosowany w leczeniu pasożytozy rybnej w akwariach, które wytwarzają infekcje jelit i wrzodów skóry.
Uzdatnianie wody
Jest to regeneracja chemiczna stosowana do usuwania żelaza, magnezu i siarkowodoru z wody (nieprzyjemnego zapachu), będąc w stanie użyć do oczyszczania ścieków.
Stado żelaza i magnezu w postaci jego nierozpuszczalnych tlenków wody. Ponadto pomaga usunąć rdzę obecną w rurach.
Ochrona owoców
Permanganinian potasu usuwa etylen wytwarzany w bananach podczas przechowywania, pozwalając mu pozostać przez ponad 4 tygodnie bez dojrzewania, w tym w temperaturze pokojowej.
W Afryce używają go do namoczenia warzyw, w celu zneutralizowania i eliminowania dowolnego obecnego środka bakteryjnego.
Działanie ogniowe
Permanganan potasu służy do ograniczenia przedłużenia pożaru. W oparciu o zdolność nadmanganianu do rozpoczęcia pożaru, służy do tworzenia przeciwników w pożarach lasów.
Tytuł Redox
W chemii analitycznej jego znormalizowane roztwory wodne są stosowane jako tytuł utleniacza w oznaczeniach redoks.
Odczynnik organiczny
Służy do przekształcania alkenów w diole; to znaczy dwie grupy OH są dodawane do podwójnego wiązania C = C. Poniższe równanie chemiczne:

Również w roztworze kwasu siarkowego z kwasem chromowym (H (H2Cro4) Jest stosowany do utleniania pierwotnych alkoholi (R-OH) do kwasów karboksylowych (R-COOH lub RCO2H).
Może ci służyć: nie -spolarne kowalencyjne wiązanieJego moc utleniająca jest wystarczająco silna, aby utlenić pierwotne lub wtórne grupy alkilowe związków aromatycznych „karboksyling”; to znaczy przekształcanie łańcucha bocznego R (na przykład Cho3) W grupie Cooh.
Zastosowania historyczne
Był częścią proszków używanych jako lampy błyskowej w fotografii lub do rozpoczęcia reakcji termitu.
Został użyty podczas II wojny światowej do kamuflażu białych koni w ciągu dnia. W tym celu użyli dwutlenku manganu (MNO2), który jest brązowy; W ten sposób niezauważono.
Synteza KMNO4
Minerał pirolusite zawiera dwutlenek manganu (MNO2) i węglan potasowy (CACO3).
W 1659 r. Chemik Johann r. Glauber stopił minerał i rozpuścił go w wodzie, obserwując wygląd zielonego zabarwienia w roztworze, który później zmienił się w fioletowym kolorze i na wreszcie czerwony. Ten ostatni kolor odpowiadał generowaniu nadmanganianu potasu.
W połowie XIX wieku Henry Condry szukał produktu antyseptycznego i początkowo traktował pirolusit NaOH, a później KOH, wytwarzając SA -called Condy Crystals; to znaczy nadmanganian potasu.
Permanganan potasu jest produkowany przemysłowo z dwutlenku manganu obecnego w minerałach pirolusite. MNO2 obecny w minerałach reaguje z wodorotlenkiem potasu, a następnie ogrzewa się w obecności tlenu.
2 Mno2 + 4 Koh +lub2 => 2 K2Mne4 + 2 godz2ALBO
Manganian potasu (k2Mne4) jest przekształcany w nadpisaninian potasu przez utlenianie elektrolityczne w pożywkę alkaliczną.
2 K2Mne4 + 2 godz2O => 2 kmno4 + 2 koh +h2
W innej reakcji w celu wytworzenia nadmanganianu potasu manganian potasu reaguje się na CO2, Przyspieszenie procesu dysproporcji:
3 K2Mne4 + 2 co2 => 2 kmno4 + Mne2 + K2WSPÓŁ3
Może ci służyć: molekularna teoria orbitalnaZ powodu generowania MNO2 (Dwutlenek manganu) Proces jest niekorzystny, KOH musi być wygenerowany z K2WSPÓŁ3.
Właściwości KMNO4
Jest to fioletowa krystaliczna substancja stała, która topi się przy 240 ° C, która ma gęstość 2,7 g/ml i masę cząsteczkową około 158 g/mol.
Nie jest bardzo rozpuszczalny w wodzie (6,4 g/100 ml w 20 ° C), co wskazuje, że cząsteczki wody nie rozwiązują w dużej mierze jonów MNO4-, Ponieważ być może ich czworościenne geometrie wymagają dużo wody do ich rozwiązania. Podobnie może również rozpuszczać alkohol metylowy, aceton, kwas octowy i pirydyna.
Rozkład
Rozkłada się przy 240 ° C, uwalniając tlen:
2 kmno4 => K2Mne4 + Mne2 + ALBO2
Możesz doświadczyć rozkładu poprzez działanie alkoholu i innych rozpuszczalników organicznych, a także przez działanie silnych kwasów i czynników redukujących.
Moc utleniania
W tej soli mangan wykazuje swój największy stan utleniania (+7) lub to, co jest takie samo, jak maksymalna ilość elektronów, którą może stracić w sposób jonowy. Z kolei elektroniczna konfiguracja manganu wynosi 3D54S2; Dlatego w permanganinian potasu cała warstwa walencji atomu manganu jest „pusta”.
Następnie atom manganu przedstawia naturalną tendencję do zdobywania elektronów; Oznacza to, że należy sprowadzić do innych stanów utleniania w pożywkach alkalicznych lub kwaśnych. To jest wyjaśnienie, dlaczego kmno4 Jest to silny środek utleniający.
Bibliografia
- F.Albert Cotton i Geoffrey Wilkinson, FRS. (1980). Zaawansowana chemia nieorganiczna. Redakcja Limusa, Meksyk, wydanie 2nd, strona 437-452.
- Robin Wasserman. Zastosowania medyczne do nadmanganianu potasu. Livestrong wyzdrowiał.com
- Clark d. 3 Ultimate wykorzystuje nadpisanatyn potasowy. Odzyskane z technologii.org
- J.M. Cedardea, c. Arnáiz i E. Díaz. Permanganan potasu: potężny i wszechstronny utleniacz. Wydział. Inżynieria chemiczna i środowiska. University School of Seville.

