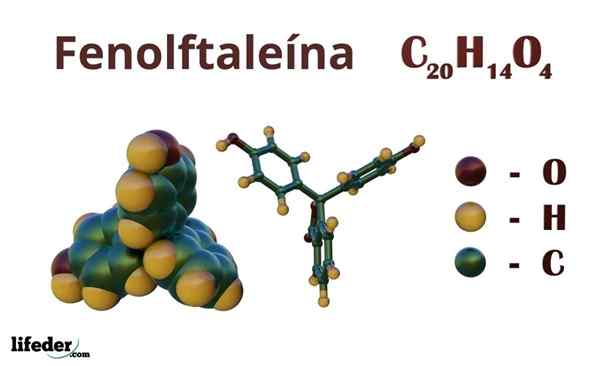
Fenolftaleina (C20H14O4)
- 857
- 120
- Bertrand Zawadzki
Co to jest fenolftaleina?
Fenolphtaleina Jest to barwnik organiczny, który z kolei jest słabym kwasem dioprotycznym, stosowanym w wielu determinacjach objętościowych jako wskaźnik kwasowo-zasadowy. To znaczy, jeśli jest to kwas diprotyczny, w roztworze można stracić dwa jony H+, I aby być wskaźnikiem, musisz mieć własność kolorowego w zakresie cenionym.
W podstawowym pożywce (pH> 8) fenolftaleina jest różowa, którą można nasilić do fioletowego czerwieni. Aby być stosowanym jako wskaźnik kwasowo-zasadowy, nie należy reagować szybciej z OH- środowiska, które analizuje w celu ustalenia.
Ponadto, ponieważ jest to bardzo słaby kwas, obecność grup -COOH jest wykluczona, a zatem źródłem protonów kwasowych są dwie grupy OH związane z dwoma pierścieniami aromatycznymi.
Formuła
Fenolftaleina jest związkiem organicznym, którego skondensowana wzór chemiczny wynosi c20H14ALBO4. Chociaż być może nie wystarczy, aby odkryć, które grupy organiczne posiada, z formuły można obliczyć nienasycenie, aby rozpocząć wyjaśnienie szkieletu.
Struktura chemiczna
 Struktura fenoloftaleiny
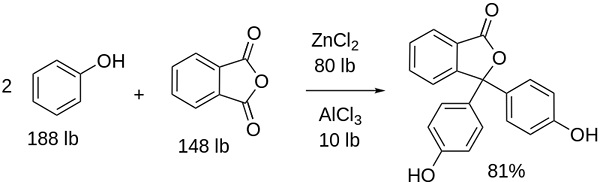
Struktura fenoloftaleiny Struktura fenoloftaleiny jest dynamiczna, co oznacza, że ulega jej zmianom w zależności od pH otoczenia. Na górnym obrazie ilustrują struktura fenoloftaleiny w zakresie 0 To pierścień pięciokąta, który cierpi na największe modyfikacje. Na przykład w podstawowym medium, gdy jedna z grup OH pierścieni fenolowych, ich obciążenie ujemne (-O-) przyciąga aromatyczny pierścień, „otwierając” pierścień pięciokąta w nowym układzie jego linków. Tutaj nowe obciążenie ujemne znajduje się w grupie -coo-, który „wyszedł” z pierścienia pięciokątnego. Następnie, po zwiększeniu zasadowości pożywki, druga grupa OH pierścieni fenolowych i powstałe obciążenie jest niszczycielskie w całej strukturze molekularnej. Niższy obraz podsumowuje wynik dwóch niedyprotonacji w medium podstawowym. Ta struktura jest odpowiedzialna za znane różowe zabarwienie fenoloftaleiny. Elektrony, które „przemieszczają” przez sprzężony układ π (reprezentowany z podwójnymi wiązaniami rezonansowymi) wchłania się w widmie widzialnym, w szczególności do długości fali żółtego koloru, odzwierciedlając różowy kolor, który dociera do oka przyszłego. Fenolftaleina ma w sumie cztery struktury. Dwa poprzednie są najważniejsze pod względem praktycznym i są reprezentowane w skrócie jako: h2W2-. Fenoloftaleina jest stosowana w analizie chemicznej jako wskaźnik wzrokowy w określaniu punktu równoważności w reakcjach neutralizacji lub stopniach kwasowych zasad. Odczynnik dla tych ocen kwasowo-zasadowych jest przygotowywany z 1 % rozpuszczonym w 90 % alkoholu. Fenolphtaleina przedstawia 4 stany: To zachowanie pozwoliło na zastosowanie fenoloftaleiny jako wskazania nasycenia betonu, które zmieniają pH do wartości od 8,5 do 9. Ponadto zmiana zabarwienia jest bardzo nagła; to znaczy anion2- Różowy jest produkowany z dużą prędkością. W związku z tym pozwala to być kandydatem jako wskaźnikiem w wielu określeniach objętościowych; Na przykład, słabego kwasu (kwas octowy) lub silnego (kwas solny). Fenolftaleina zastosowano jako środek przeczyszczający. Istnieje jednak wskazująca literatura naukowa, że niektóre środki przeczyszczające, które zawierają fenoloftaleinę jako aktywną zasadę - która działa hamując wchłanianie wody i elektrolitów w ewakuacjach promujących jelito grube - mogą mieć negatywne skutki skutki negatywne. Przedłużone stosowanie tych leków zawierających fenoloftaleinę wiąże się z wytwarzaniem kilku zaburzeń w funkcjonowaniu jelit, zapaleniu trzustki, a nawet raka, wytwarzane głównie u kobiet i modeli zwierzęcych stosowanych do badania farmakologicznego tego związku chemicznego związku chemicznego. Zmodyfikowana chemicznie fenoloftaleina, a następnie przekształcaj ją w jej zmniejszony stan, jest stosowany jako odczynnik w testach kryminalistycznych, które umożliwiają określenie obecności hemoglobiny w próbce (test Kastle-Meyer), co nie jest rozstrzygające ze względu na obecność fałszywie dodatnich. Powstaje przez kondensację bezwodnika ftalicznego z fenolem, w obecności stężonego kwasu siarkowego oraz mieszaniny chlorków aluminiowych i cynkowych jako katalizatorów reakcji: Aromatyczne podstawienie elektrofilowe jest mechanizmem regulującym tę reakcję. Z czego to się składa? Pierścień fenolowy (cząsteczka po lewej) jest negatywnie ładowany dzięki atomowi tlenu bogatemu w elektrony, który jest w stanie zrobić dowolną wolną parę przemieszczania się „obwodu elektronicznego” pierścienia. Z drugiej strony węgiel grupy C = O bezwodnego ftalicznego. Pierścień fenolowy, bogaty w elektrony, atakuje ten słaby węgiel w elektronach, zawierający pierwszy pierścień do konstrukcji. Ten atak występuje preferencyjnie na przeciwnym końcu węgla powiązanego z grupą OH; To jest pozycja -Do. To samo dotyczy drugiego pierścienia: atakuje ten sam węgiel, a na podstawie tego wytworzona cząsteczka wody jest uwalniana dzięki kwaśnej pożywce. W ten sposób fenoloftaleina jest niczym więcej niż ftaliczną cząsteczką bezwodnika, która włączyła dwa pierścienie fenolowe do jednej z jego grup Carbonillus (C = O). Jego wygląd fizyczny dotyczy białej substancji stałej z trójklinicznymi kryształami, często aglomerowanymi lub w postaci rombowych igieł. Jest to toaleta, gęstsza niż woda płynna (1277 g/ml w 32 ° C) i bardzo mało lotne (szacowane ciśnienie pary: 6,7 x 10-13 MMHG). Jest bardzo mało rozpuszczalny w wodzie (400 mg/l), ale bardzo rozpuszczalny w alkoholu i eterze. Z tego powodu zaleca się rozcieńczenie go w etanolu przed użyciem. Jest nierozpuszczalny w aromatycznych rozpuszczalnikach, takich jak benzen i toluen, lub w hydrokarbonach alifatycznych, takich jak n-heksan. Znalezione w 262,5 ° C, a ciecz ma temperaturę wrzenia 557,8 ± 50,0 ° C do ciśnienia atmosferycznego. Wartości te wskazują na silne interakcje międzycząsteczkowe. Wynika to z mostów wodorowych, a także przednich interakcji między pierścieniami. Jego PKA wynosi od 9,7 do 25 ° C. Przekłada się to na bardzo niski trend do dysocjacji w środowisku wodnym: H2W (ac) + 2H2Lub (l) w2-(AC) + 2H3ALBO+ To jest równowaga wodna. Jednak wzrost jonów OH- W roztworze obecna ilość H maleje3ALBO+. W konsekwencji równowaga porusza się w prawo, aby uzyskać więcej h3ALBO+. W ten sposób jego początkowa strata jest nagradzana. W miarę dodawania większej podstawy równowaga wciąż przesuwa się w prawo i tak dalej, dopóki nie ma nic z gatunku2W. W tym momencie gatunek2- Rosado pokoloruj rozwiązanie. Wreszcie, fenolftaleina rozkłada się podczas ogrzewania, emitując akr i irytujący dym.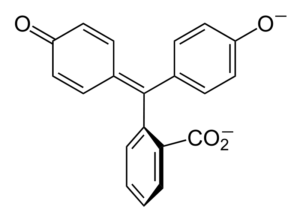
Używa/zastosowania fenoloftaleiny
 Dodanie roztworu alkalicznego do neutralnego roztworu z wskaźnikiem fenoloftaleiny
Dodanie roztworu alkalicznego do neutralnego roztworu z wskaźnikiem fenoloftaleiny Funkcja wskaźnika
Stosowanie w medycynie
Synteza fenoloftaleiny
Właściwości fenolftaleiny
Bibliografia