Struktura cytozyny, funkcje, właściwości, synteza
- 4163
- 257
- Filip Augustyn
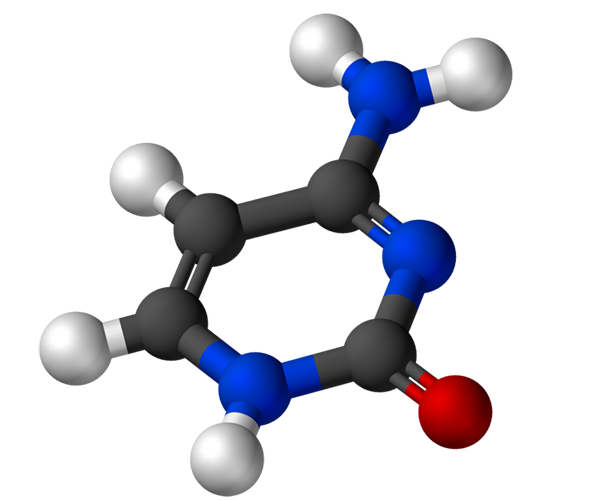
Cytozyna Jest to podstawa azotu pirymidynowego, która służy do biosyntezy cytydyny-5'-monofosforanu i dekscytydyny-5'-monofosforanu. Związki te służą odpowiednio do biosyntezy z kwasu deoksyrybonukleinowego (DNA) i kwasu rybonukleinowego (RNA). DNA przechowuje informacje genetyczne, a RNA ma różne funkcje.
W żywych istotach cytozyna nie występuje swobodnie, ale powszechnie rybonukleotydy lub deoksyrybonukleotydy. Oba rodzaje związku mają grupę fosforanową, rybozę i podstawę azotu.
 Źródło: Vesprcom [domena publiczna]
Źródło: Vesprcom [domena publiczna] Węgiel 2 rybozy ma grupę okshyydrillo (-OH) w rybonukleotydach i atom wodoru (-H) w dezoksyrybonukleotydach. W zależności od liczby obecnych grup fosforanów występuje Citidín-5'-monofosforan (CMP), Citidín-5'-difosforan (CDP) i Citidín-5'-triffosforan (CTP) (CTP).
Desooksygenowane równoważniki nazywane są deoksicydyną-5'-monofosforanem (DCMP), dezoksycydyną-5'-difosforanem (DCDP) i deoksicydyny-5'-triffosforanu (DCTP).
Cytozyna w różnych formach uczestniczy w różnych funkcjach, takich jak biosynteza DNA i RNA, biosynteza glikoprotein i regulacja ekspresji genu.
[TOC]
Struktura i właściwości
Cytozyna, 4-amino-2-hydroksipirimidyna, ma wzór empiryczny C4H5N3Lub, którego masa cząsteczkowa wynosi 111,10 g/mol i jest oczyszczona jako biały proszek.
Struktura cytozyny jest heterocyklicznym, aromatycznym i płaskim pierścieniem. Maksymalna długość fali absorbancji (ʎMax) To 260 nm. Temperatura fuzji cytozyny przekracza 300 ° C.
Aby utworzyć nukleotyd, cytozyna wiąże się kowalencyjnie, przez azot 1, za pomocą środków. Węgiel 5 'jest estryfikowany za pomocą grupy fosforanowej.
Biosynteza
Biosynteza nukleotyny pirymidyny ma wspólny szlak, który składa się z sześciu etapów katalizowanych przez enzymy. Droga zaczyna się od biosyntezy karbamoile-fosforan. W prokariotach jest tylko jeden enzym: syntaza fosforanowa karbamialu. Jest to odpowiedzialne za syntezę pirymidyn i glutaminy. W eukariotach znajduje się syntaza fosforanu karbamowskiego I i II, które są odpowiednio odpowiedzialne za biosyntezę glutaminy i pirymidyny.
Drugi krok polega na tworzeniu N-karbamoilaspartato, z fosforanu węglowodanów i asparaginianu, reakcji katalizowanej przez transkarparat Transcabamoilasa (ATCASA).
Trzecim krokiem jest synteza Dihydrotoate L, który powoduje zamknięcie pierścienia pirymidynowego. Ten krok jest katalizowany przez dihydrootazę.
Czwarty krok to tworzenie Orotato, które jest reakcją redoks katalizowaną przez dehydrogenazę dihydroorotatanową.
Piąty krok polega na tworzeniu złota (OMP) przy użyciu pirofosforanu fosforybozylowego (PRPP) jako substratu, a fosforybosyl -orotate transferaza jako katalizator jako katalizator.
Szósty krok to tworzenie się urydilaato (urydyna-5'-monofosforanu, UMP), reakcji katalizowanej przez Ompedarboksylazę.
Może ci służyć: flora i fauna z HidalgoPoniższe etapy składają się z fosforylacji UMP, katalizowanej przez kinazy, z utworzeniem UTP, oraz przeniesienia grupy aminowej z glutaminy do UTP w celu utworzenia CTP, reakcji katalizowanej przez syntazę CTP.
Regulacja biosyntezy
U ssaków regulacja odbywa się w syntazie fosforanu węglowodanów.
Carbamoil Syntasa II jest regulowany przez negatywne informacje zwrotne. Jego regulatory, UTP i PRPP, są odpowiednio inhibitorem i aktywatorem tego enzymu.
W tkankach, które nie są wątroby, syntaza fosforanu karbamowskiego II jest jedynym źródłem fosforanu karbamowskiego. Podczas gdy w wątrobie, w warunkach nadmiaru amoniaku, syntaza fosforanu karbamowskiego I wytwarza, w mitochondriach, fosforan karbamiłowy, który jest transportowany do cytosolu, skąd wchodzi na ścieżkę biosyntezy pirymidyny.
Innym punktem regulacji jest OMP-discarbokslaza, która jest regulowana przez konkurencyjne zahamowanie. Produkt jego reakcji, UMP, konkuruje z OMP dla miejsca wiązania w OMP-Descarboxilasa.
Pirymidyn, podobnie jak cytozyna, są poddawane recyklingowi
Recykling pirymidyn działa w funkcji ponowne wykorzystanie pirymidyn bez potrzeby biosyntezy Novo i unikaj ścieżki degradacji. Reakcja recyklingu jest katalizowana przez fosforybozylotransferazę pirymimidynową. Ogólna reakcja jest następująca:
Pirymidyn + PRPP -> Nukleozyd pirymidyn 5 ' -monofosforan + PPI
U kręgowców fosforybozylotransferaza pirymimidyna znajduje się w erytrocytach. Podłoże pirymidyn tego enzymu to uracyl, Timina i Orotato. Cytozyna jest pośrednio recyklingowa z monofosforanu Uridin-5'.
Funkcja w biosyntezy DNA
Podczas replikacji DNA informacje zawarte w DNA są kopiowane w DNA przez polimerazę DNA.
Biosynteza RNA potrzebuje tryfosforanu deoksynukleotydów (DNTP), a mianowicie: Tryfosforan deksytimidowy (DTTP), triffosforan deksicidy (DCTP), de -alxyxyadeninowa (DATP) i tryfosforan deksiguaniny (DGTP). Reakcja to:
(DNA)n marnotrawstwo + Dntp -> (DNA)N+1 Waste + PPI
Hydroliza pirofosforanu nieorganicznego (PPI) zapewnia energię do biosyntezy RNA.
Funkcja w stabilizacji struktury DNA
W podwójnej helisie DNUS puryna łańcucha jest powiązana z pirymidyną, z przeciwnego łańcucha, wiązaniami wodorowymi. Zatem cytozyna jest zawsze powiązana z guaniną przez trzy wiązania wodorowe: adenina jest powiązana z timiną przez dwa wiązania wodorowe.
Może ci służyć: znaczenie biologiiWiązania wodorowe są zepsute, gdy oczyszczony natywny roztwór DNA o pH 7 jest poddawany temperaturom większym niż 80 ° C. To powoduje, że podwójny śmigło DNA tworzy dwa oddzielne łańcuchy. Proces ten jest znany jako denaturacja.
Temperatura denaturowana 50% DNA jest znana jako temperatura topnienia (TM). Cząsteczki DNA, których guanina i cytozyna.
Powyższe jest testem eksperymentalnym, że większa liczba wiązań wodorowych lepiej stabilizuje natywne cząsteczki DNA.
Funkcja bogatych regionów w cytozynie w DNA
Ostatnio stwierdzono, że DNA jądra ludzkiej komórki może przyjmować interkalowane struktury motywów (IM). Struktury te są wytwarzane w regionach cytozynowych.
Struktura IM składa się z czterech łańcuchów DNA, w przeciwieństwie do klasycznego podwójnego śmigła DNA, który ma dwa łańcuchy. Mówiąc dokładniej, dwa równoległe łańcuchy dupleksowe są przeplatane w orientacji antyrównoległości i są utrzymywane razem przez parę cytozinów hemiprotonowych (C: C: C: C: C: C+).
W ludzkim genomie struktury IM znajdują się w regionach takich jak promotory i telomery. Liczba struktur IM jest wyższa podczas fazy G1/S cyklu komórkowego, w której transkrypcja jest wysoka. Te regiony to miejsca rozpoznawania białka zaangażowane w aktywację maszyn transkrypcyjnych.
Z drugiej strony, w regionach bogatych w zasady guanine (c) kolejne, DNA ma tendencję do przyjmowania śmigła A, w warunkach odwodnienia. Ta forma jest typowa dla pasm mieszanych RNA i podwójnych DNA-arn podczas transkrypcji i replikacji, a w określonych momentach, gdy DNA jest powiązane z białkiem.
Wykazano, że regiony z kolejnymi zasadami cytozynowymi tworzą elektropozytywną łatkę w głównej rozszczepieniu DNA. Dlatego uważa się, że regiony te wiążą się z białkami, które predysponują niektóre genomowe regiony kruchości genetycznej.
Funkcja w biosyntezy RNA
Podczas transkrypcji informacje zawarte w DNA są kopiowane w RNA przez RNA polimerazy Pon. Biosynteza RNA wymaga nukleozydów tryposforanu (NTP), a mianowicie: Tryfyse cytidina (CTP), tryposforan urydyna (UTP), adeniny tryposforan (ATP) i guanina tryfosforanu (GTP). Reakcja to:
Może ci służyć: flora i fauna Campeche: reprezentatywne gatunki(RNA)n marnotrawstwo + NTP -> (RNA)N+1 Waste + PPI
Hydroliza pirofosforanu nieorganicznego (PPI) zapewnia energię do biosyntezy RNA.
Funkcja w biosyntezy glikoprotein
Sekwencyjne przeniesienie heksoz z tworzeniem oligosacharydów, O-ligaty do białek, odbywa się z prekursorów nukleotydowych.
U kręgowców ostatni etap biosyntezy oligosacharydów O-ligowanych polega na dodaniu dwóch odpadów kwasu sinalnego (N-acetyloneuraminy) z prekursora cytidiny-5'-monofosforanu (CMP). Ta reakcja jest wytwarzana w worku trans Golgiego.
Cytozyna i chemioterapia za leczenie raka
Kwas tetrahydrofolanowy (FH4) jest źródłem grupy -ch3, I jest to konieczne do biosyntezy DTMP z zrzutu. FH2 jest również tworzone. Redukcja FH2 do FH4 wymaga folianu i reduktazy NADPH. Niektóre inhibitory reduktazy folianowej, takie jak aminopterina i metretotrexat, są stosowane w leczeniu raka.
Metotrexan jest konkurencyjnym inhibitorem. Reduktaza kwasu foliowego łączy się ze 100 razy większym powinowactwem do tego inhibitora niż do podłoża. Aminapterina działa podobnie.
Hamowanie reduktazy folianowej pośrednio utrudnia biosyntezę DTMP, a zatem za hamowanie DCTP. Bezpośrednie zahamowanie zachodzi poprzez inhibitory syntetazy starynowej, która katalizuje DTMP z zrzutu. Te inhibitory to 5-fluorouracyl i 5-fluoro-2-dioksiurydyna.
Na przykład 5-fluoroocyl nie jest inhibitorem, ale najpierw staje się, że trasa recyklingu, w dezoksyuridowym mofosforan D (FDUMP), który wiąże się z nieśmiałem syntezazy i hamuje ją.
Substancje analogiczne do glutaminy, azaseryny i acywicyny, hamują amidotransferazę glutaminy. Azaryna była jedną z pierwszych odkrytych substancji, które działają jako samobójcze inaktywujące.
Bibliografia
- Assi, h.DO., Garavís, m., González, c., I Damha, m.J. 2018. I-Motif DNA: cechy strukturalne i znaczenie dla biologii komórkowej. Badanie kwasów jąder, 46: 8038-8056.
- Bohinski, r. 1991. Biochemia. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, t.M. 2000. Biochemia. Redakcja Reverté, Barcelona.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, s. 1., Baltimore, zm., Darnell, J. 2003. Biologia komórkowa i molekularna. Redakcja Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madryt, Meksyk, Sāo Paulo.
- Nelson, zm. L., Cox, m. M. 2008. Lehninger-Principles of Biochemistry. W.H. Freeman, Nowy Jork.
- Voet, d. i Voet, J. 2004. Biochemia. John Wiley and Sons, USA.
- « Budżet dochodu na to, jaki jest zastosowanie i przykłady
- Struktura kardiolipiny, synteza, funkcje »

