Charakterystyka cysteiny, struktura, funkcje, biosynteza
- 979
- 282
- Pani Waleria Marek
Cysteina (Cys, c) jest jednym z 22 aminokwasów znalezionych w naturze jako część łańcuchów polipeptydowych, które tworzą białka żywych istot. Jest niezbędny dla stabilności trzeciorzędowych struktur białek, ponieważ pomaga w tworzeniu wewnątrzcząsteczkowych mostów disiarczkowych.
Oprócz tego, że dotyczy to innych aminokwasów, takich jak alanina, arginina, asparagina, glutaminian i glutamina, glicyna, prolina, seryn i tyrozyna, ludzie są w stanie syntetyzować cysteinę, więc nie jest to uważane za niezbędne aminokwasowe.
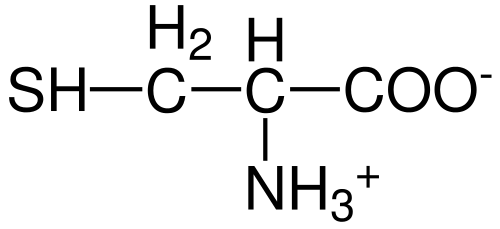
 Struktura aminokwasów cysteiny (źródło: Hattrich [domena publiczna] przez wikimedia Commons)
Struktura aminokwasów cysteiny (źródło: Hattrich [domena publiczna] przez wikimedia Commons) Pomimo tego, i biorąc pod uwagę fakt, że wskaźniki syntezy nie zawsze dostarczają wymagań ciała, niektórzy autorzy opisują cysteinę jako „warunkowo” zasadniczo „aminokwas.
Ten aminokwas został nazwany przez „Cystinę”, składnik obliczeń pęcherzyków odkrytych w 1810 r., Które nazwisko zostało wymyślone w 1832 r. Przez a. Baudrimont i f. Malaguti. Kilka lat później, w 1884 roku i. Baumann odkrył, że cysteina była produktem redukcji cystyny.
Po pracy wykonanej przez Baumana w 1899 r.
Obecnie wiadomo, że cysteina ciała pochodzi z żywności, recyklingu białek i endogennej syntezy, która występuje głównie w hepatocytach.
[TOC]
Charakterystyka
Cysteina ma masę cząsteczkową 121.16 g/mol i znajduje się wraz z leucyną, izoleucyną, waliną, fenyloalaniną, tryptofanem, metioniną i tyrozyną, wśród najbardziej hydrofobowych aminokwasów.
Należy do grupy aminokwasów polarnych bez obciążenia i, podobnie jak inne aminokwasy, można go degradować przez hydrolizę alkaliczną w wysokich temperaturach.
Podobnie jak tryptofan, seryn, glicyna i tremena, cysteina jest metabolicznym prekursorem glukoneogenezy i ketogenezy (tworzenie ciał ketonowych).
Ten aminokwas istnieje jako część sekwencji peptydu białek, ale może być również wolny w osoczu krwi jako jednorodne disiarczki (cystyna, pochodna) lub mieszana, złożona z postaci homocysteiny-cysteiny.
Główną różnicą między wolną cysteiną a tą znalezioną w strukturze białka jest to, że pierwsza jest w bardzo zardzewiałym stanie redoks, podczas gdy ostatnia jest zwykle dość zmniejszona.
Struktura
Podobnie jak w przypadku reszty opisanych do tej pory aminokwasów, cysteina ma centralny atom węglowy, który jest chiralny i jest znany jako węgiel α.
Cztery różne gatunki chemiczne są połączone z tym atomem węgla:
- Grupa aminowa (-NH3+)
- Grupa karboksylowa (-CO-)
- atom wodoru i
- Podstawnik (-r).
Grupa podstawna jest tą, która nadaje tożsamość każdemu aminokwasowi, a cysteina charakteryzuje się zawieraniem atomu siarki jako części grupy Tiol albo Sulfhydrillo (-Ch2-sh).

To właśnie ta grupa pozwala jej uczestniczyć w tworzeniu wewnątrzinteroterapekularnych mostów disiarczkowych. Ponieważ jest to nukleofil, możesz również uczestniczyć w reakcjach podstawienia.
W rzeczywistości ten łańcuch boczny cysteiny można modyfikować w celu tworzenia dwóch związków znanych jako „selenocysteina” i „lantyonina”. Pierwszym z nich jest aminokwas, który również uczestniczy w tworzeniu białka, a drugi to pochodna aminokwasów nie -białko.
Może ci służyć: Histony: Charakterystyka, struktura, typy i funkcjeGrupa tiol cysteiny charakteryzuje się również jej wielkim powinowactwem do jonów srebra i rtęci (AG+ i HG2+).
Funkcje
Główne funkcje cysteiny w żywych organizmach mają związek z ich uczestnictwem w tworzeniu białka. W szczególności cysteina uczestniczy w tworzeniu mostów disiarczkowych, które są niezbędne do tworzenia trzeciorzędowej struktury białka.
Ponadto ten aminokwas jest nie tylko przydatny w syntezie białek, ale także uczestniczy w syntezie glutationu (GSH) i zapewnia zmniejszoną siarkę do metioniny, kwasu lipogoinowego, tiaminy, koenzymu A (COA), molibdopteriny (kofaktor) i innych Związki o znaczeniu biologicznym.
W warunkach nadmiernej ilości siarków aminokwasów, cysteina i inne powiązane aminokwasy mogą być stosowane do produkcji nieorganicznego pirogronianu i siarki. Pyrogronian udaje się przekierować w kierunku trasy glukoneogennej, służąc do produkcji glukozy.
Keratyny, które są jednym z najliczniejszych rodzajów białek strukturalnych w królestwie zwierząt, są bogate w reszty cysteinowe. Na przykład wełna owiec zawiera ponad 4% siarki z tego aminokwasu.
Cysteina uczestniczy również w wielu reakcjach redukcyjnych tlenku, więc jest częścią aktywnego miejsca niektórych enzymów.
Podczas reakcji z glukozą ten aminokwas wytwarza produkty reakcyjne, które wprowadzają atrakcyjne gusta i aromaty do niektórych preparatów kulinarnych.
Biosynteza
Biosynteza aminokwasów w ludzkim ciele i u innych zwierząt (ssaków i nie-ssaków) ma miejsce w postaci tkankowej i klasy komórkowej; Jest to proces zasługujący na energię i jest zwykle oddzielony między różnymi narządami.
Wątroba jest jedną z głównych narządów zaangażowanych w syntezę większości nieistotnych aminokwasów, niezależnie od rozważanego gatunku.
W tym nie tylko cysteina jest syntetyzowana, ale także asparaginian, asparagina, glutaminian i glutamina, glicyna, seryna, tyrozyna i inne z jej specyficznych prekursorów aminokwasów.
W 1935 r. Erwin Brand ustalił, że cysteina u ssaków jest naturalnie syntetyzowana z metioniny, która odbywa się wyłącznie w tkance wątroby.
Proces ten może wystąpić z powodu „nadajnika” metioniny, gdzie grupy metylowe są przenoszone na wzgórze i kreatynę. Jednak cysteina może być również utworzona z metioniny dzięki transulfuracji.
Następnie wykazano, że oprócz metioniny niektóre syntetyczne związki, takie jak N-acetylowa cysteina, cysteamina i cystaminowa, są przydatnymi prekursorami syntezy cysteiny.
W przypadku cysteiny N-acetylowej jest to przyjmowane przez komórki, gdzie jest ona przekształcana w cysteinę przez enzym cytosolu w cytosolu.
Mechanizm syntezy
Mechanizm syntezy cysteiny z najbardziej znanej metody jest mechanizm trans -Ulo. Dzieje się tak głównie w wątrobie, ale zostało również określone w jelicie i trzustce.
Dzieje się tak z homocysteiny, związku pochodzącej z metody aminokwasowej; A pierwszą reakcją tej trasy biosyntetycznej jest kondensacja katalizowana przez enzym β-sentazy (CBS) (CBS).
Może ci służyć: uracyl: struktura, funkcje, właściwości, syntezaTen enzym reprezentuje przejście „zaangażowania” trasy i kondensuje homocystein. Następnie ten związek jest „cięty” lub „podzielony” przez enzym Cistationasa, który prowadzi do uwolnienia cysteiny.
W regulacji aktywności enzymatycznej CBS pośredniczy dostępność metody i stan redoks komórki, w którym występuje ten proces.
Poprzez drogę syntezy cysteiny komórki mogą poradzić sobie z nadmiarem metody, ponieważ ich konwersja do cysteiny jest nieodwracalnym procesem.
Synteza cysteiny w roślinach i mikroorganizmach
W tych organizmach cysteina jest syntetyzowana głównie z nieorganicznej siarki, która jest najliczniejszym źródłem użytecznej siarki w biosfery tlenowej.
Jest to przyjmowane, dostaje się do komórek, a następnie jest redukowane do siarczku (S2-), który jest włączony do cysteiny w podobny sposób, jak to, co dzieje się z amonem w syntezie glutaminianu lub glutaminy.
Metabolizm i degradacja
Cysteina katabolizmu występuje głównie w komórkach wątroby (hepatocyty), chociaż może również występować w innych typach komórek, takich jak neurony, komórki śródbłonka i komórki mięśni gładkich naczyniowej ciała.
Niektóre wady katabolizmu cysteiny wytwarzają dziedziczną chorobę znaną jako „cystinuria”, charakteryzująca się obecnością obliczeń cystyny w nerkach, pęcherzu i moczowniku.
Cystyna jest aminokwasem pochodzącym z cysteiny, a obliczenia powstają przez połączenie dwóch cząsteczek przez ich atomy siarki.
Część metabolizmu cysteiny powoduje tworzenie się kwasu naukowego, z którego powstaje walk byków, aminokwas nieprotetyczny. Reakcję jest katalizowana przez enzym cysteinowy dioksigenas.
Dodatkowo cysteina może być utleniona przez formaldehyd w celu wytworzenia cysteiny N-formilowej, której późniejsze przetwarzanie może prowadzić do tworzenia „towarów” (produkt kondensacji cystein z związkami aromatycznymi).
U zwierząt stosuje się również cysteinę, a także glutaminian i glutaminę, do syntezy koenzymu A, glutationu (GSH), pirogronianu, siarczanu i kwasu siarkowego.
Jedna z metod konwersji z cysteiny na pirogronian występuje w dwóch etapach: pierwszy implikuje usunięcie atomu siarki, a druga reakcja transaminacyjna.
Nerki są odpowiedzialne za wydalanie siarczanów i siarków pochodzących z metabolizmu związków siarki, takich jak cysteina, podczas gdy płuca wydechują dwutlenek siarki i kwas siarkowy.
Glutation
Glutation, cząsteczka utworzona przez trzy aminokwasowe odpady (glicyna, glutaminian i cysteina) to cząsteczka obecna w roślinach, zwierzętach i bakteriach.
Ma specjalne właściwości, które sprawiają, że jest to doskonały „bufor” redoks, ponieważ chroni komórki przed różnymi rodzajami stresu oksydacyjnego.
Pokarmy bogate w cysteinę
Cysteina znajduje się naturalnie w żywności, która zawiera siarkę jako żółtka (żółty) jaj, czerwonej papryki, czosnku, cebuli, brokułów, kalafiora, colliflowera, collils i bruksel.
Jest również obecny głównie w żywności z białkami, takimi jak mięso, rośliny strączkowe i produkty mleczne, w tym:
Może ci służyć: owalbumina: struktura, funkcje, denaturacja- Mięso krowie, wieprzowina, kurczak i ryby
- Owies i soczewica
- Ziarna słonecznika
- Jogurt i ser
Korzyści z spożycia cysteiny
Uważa się, że jego spożycie zapobiega wypadaniu włosów i stymuluje jego wzrost. W przemyśle spożywczym jest bardzo używany jako spanaciakowy środek masażu, a także do „odtwarzania” smaków podobnych do mięsa.
Inni autorzy podkreślili, że spożycie suplementów diety lub żywności o żywności zmniejsza.
Niektóre suplementy diety związane z cysteiną są stosowane przez ludzi jako przeciwutleniacze, co jest uważane za korzystne z punktu widzenia „opóźnienia” starzenia się.
N-acetylowa cysteina (prekursor syntezy cysteiny) jest traktowany jako suplement odżywczy, ponieważ powoduje to wzrost biosyntezy glutationu (GSH).
Powiązane choroby
Istnieje pewne publikacje naukowe, które dotyczą wysokiego poziomu cysteiny w osoczu z otyłością i innymi powiązanymi patologiami, takimi jak choroby sercowo -naczyniowe i inne zespoły metaboliczne.
Cystinuria, jak wspomniano powyżej, jest patologią związaną z obecnością kamieni cystynowych, pochodną zip, z powodu wady genetycznej w reabsorpcji aminokwasów dibasowych, takich jak cystyna.
Zaburzenia niedoboru
Niedobór cysteiny jest związany ze stresem oksydacyjnym, ponieważ jest to jeden z głównych prekursorów syntezy glutationu. Dlatego niedobory tego aminokwasu mogą prowadzić do przedwczesnego starzenia się i wszystkich mieszkań, które to znaczy.
Eksperymentalnie wykazano, że suplementacja cysteiny poprawia funkcje mięśnia szkieletowego, zmniejsza związek między tłuszczem i beztłuszczowym masą ciała, zmniejsza poziomy cytokin zapalnych w osoczu, poprawia funkcje układu odpornościowego itp.
W połowie lat 90. niektóre badania sugerowały, że zespół nabyty niedobór odporności (AIDS) może być konsekwencją niedoboru cysteiny wywołanej przez wirusa.
Te stwierdzenia były poparte faktem, że badani pacjenci z Hi-dodatnim mieli niski poziom cystyny i cystiny w osoczu, oprócz zmniejszonego wewnątrzkomórkowego stężenia glutationu.
Bibliografia
- Dröge, w. (1993). Niedobór cysteiny i glutationu u pacjentów z AIDS: uzasadnienie leczenia N-acycylo-cykodwizy. Farmakologia, 46, 61-65.
- Dröge, w. (2005). Stres oksydacyjny i starzenie się: starzenie się zespołu niedoboru cysteiny? Transakcje filozoficzne Królewskiego Towarzystwa B: Nauki biologiczne, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, h. (2011). Cysteina i otyłość. Otyłość, 20(3), 1-9.
- Kridich, n. (2013). Biosynteza cysteiny. ECosal Plus, 1-30.
- McPherson, r. DO., I Hardy, G. (2011). Korzyści kliniczne i odżywcze suplementów białkowych wzbogaconych w cysteinę. Obecna opinia w zakresie odżywiania klinicznego i opieki metabolicznej, 14, 562-568.
- Mokhtari, v., Afsharian, s. 1., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). Recenzja różnych zastosowań cysteiny n-acetylowej. Cell Journal, 19(1), 11-17.
- Piste, s. 1. (2013). Antyoksydant cysteiny-mistrza. International Journal of Pharmaceutical, Chemical and Biological Sciences, 3(1), 143-149.
- Quig, d. (1998). Metabolizm cysteiny i toksyczność metalu. Przegląd medycyny alternatywnej, 3(4), 262-270.
- Wu, g. (2013). Aminokwasy. Biochemia i odżywianie. Boca Raton, Floryda: Taylor & Francis Group.
- « Charakterystyka uczenia się społecznego, teoria bandura, przykłady
- Wymiary edukacji społeczno -emocjonalnej, znaczenie, przedszkole »

