Struktura kwasu sulfhydowego (H2S), właściwości, zastosowania, znaczenie
- 4416
- 1419
- Estera Wojtkowiak
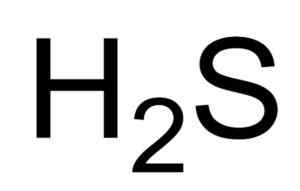
On Kwas sulfhydowy o Siarkowodór jest gazem utworzonym przez połączenie atomu (sobów siarki) i dwóch atomów wodoru (H). Jego formuła chemiczna wynosi h2S. Jest również znany jako gaz siarkow. Jest to bezbarwny gaz, którego zapach staje się widoczny w zgniłych jajach.
Jest obecny w wulkanach i siarkach gorących źródłach, w gazie ziemnym i ropie naftowej. Powstaje również podczas rozkładu beztlenowego (bez tlenu) materii organicznej roślin i zwierząt. Występuje naturalnie w ciele ssaków, poprzez działanie niektórych enzymów na cysteinę, nieistotne aminokwas.
 Chemiczny wzór kwasu sulfhydowego lub siarkowodoru. Saranphong Yimklan [domena publiczna]. Źródło: Wikimedia Commons.
Chemiczny wzór kwasu sulfhydowego lub siarkowodoru. Saranphong Yimklan [domena publiczna]. Źródło: Wikimedia Commons. Wodne roztwory H2S są żrące dla metali, takich jak stal. H2S jest związkiem redukującym, który podczas reagowania z SO2 , Utlenia elementarną siarkę2 Także do siarki.
Pomimo tego, że jest bardzo toksycznym i śmiertelnym związkiem dla ludzi i zwierząt, od kilku lat jego znaczenie badano w szeregu ważnych procesów w ciele.
Reguluje serię mechanizmów związanych z generowaniem nowych naczyń krwionośnych i funkcjonowaniem serca.
Chroń neurony i pomyślałem o jego działaniach przeciwko chorobom, takim jak Parkinson i Alzheimer's.
Ze względu na jego chemiczne zmniejszenie może zwalczać gatunki utleniające, działając w ten sposób przeciwko starzeniu się komórek. Z tych powodów badana jest możliwość produkcji leków, że w przypadku dostarczania pacjentom może powoli uwolnić je w organizmie.
Służyłoby to do leczenia patologii, takich jak niedokrwienie, cukrzyca i choroby neurodegeneracyjne. Jednak ich mechanizm działania i bezpieczeństwo muszą być nadal szczegółowo zbadane.
[TOC]
Struktura
Molekula H2S jest analogiczne do wody, to znaczy przypominają swoją postać, ponieważ hydrogeny tworzą kąt z siarką.
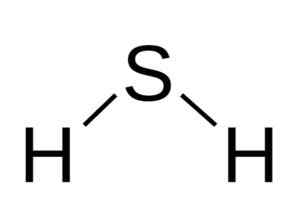 Struktura kątowa cząsteczki kwasu siarczkowego, h, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons.
Struktura kątowa cząsteczki kwasu siarczkowego, h, h2S. Bangin [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons. Siarka w godz2S ma następującą konfigurację elektroniczną:
1s2, 2s2 2 p6, 3s2 3p6,
Następnie weź elektron każdego wodoru, aby ukończyć warstwę walencyjną.
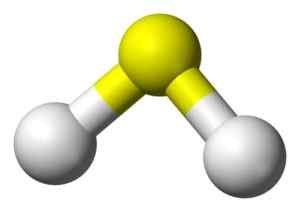 Struktura 3D kwasu siarczkowego. Żółty: siarka. Biały: wodór. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Struktura 3D kwasu siarczkowego. Żółty: siarka. Biały: wodór. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
- Kwas sulfhydowy
- Siarkowodór
- Wodorek siarki.
Właściwości fizyczne
Stan fizyczny
Bezbarwny gaz o bardzo nieprzyjemnym zapachu.
Waga molekularna
34,08 g/mol.
Temperatura topnienia
-85,60 ºC.
Punkt wrzenia
-60,75 ° C.
Gęstość
11906 g/l.
Rozpuszczalność
Umiarkowanie rozpuszczalne w wodzie: 2,77 objętości w 1 wodzie w 20 ° C. Można go całkowicie eksmitować z roztworu wodnego, przesyłając go do wrzenia.
Właściwości chemiczne
W roztworze wodnym
Gdy siarkowodór jest w roztworze wodnym, przypisana jest nazwa kwasu sulfhydowego. Jest to słaby kwas. Ma dwa jonizowane protony:
H2S + h2Lub ⇔ h3ALBO+ + HS-, KA1 = 8,9 x 10-8
HS- + H2Lub ⇔ h3ALBO+ + S2-, KA2 ∼ 10-14
Pierwszy proton jest lekko zjonizowany, jak można wywnioskować z pierwszej stałej jonizacji. Drugi proton jest bardzo mało jonizowany, ale rozwiązania H2S zawiera coś z anionu siarki2-.
Jeśli rozwiązanie H2S jest narażony na powietrze, o2 oksyda do anionu siarkowego i siarki wytrąca:
Może ci służyć: tlenki2 s2- + 4 godz+ + ALBO2 → 2 godz2O + 2 s0↓ (1)
W obecności chloru CL2, Bromo br2 i jod i2 Powstany jest odpowiedni wodór i siarka:
H2S + br2 → 2 Hbr + S0↓ (2)
Wodne roztwory H2S są żrące, powodują pękanie naprężeń z siarką w wysokich stalach. Produkty korozji to żelazo i siarkowodór.
Reakcja tlenu
H2S reaguje z tlenem powietrza i mogą wystąpić następujące reakcje:
2 godz2S + 3 O2 → 2 godz2O + 2 SO2 (3)
2 godz2S + o2 → 2 godz2O + 2 s0↓ (4)
Reakcja z metali
Reaguje z różnymi metali, które przesuwają się do wodoru i tworzą siarczk metalu:
H2S + PB → PBS + H2↑ (5)
Reakcja z dwutlenkiem siarki
W gazach wulkanicznych H są obecne2S i SO2, które reagują ze sobą i powstaje stała siarka:
H2S + SO2 → 2 godz2O + 3 s0↓ (6)
Rozkład z temperaturą
Siarkowodór nie jest bardzo stabilny, łatwo można go złamać przez ogrzewanie:
H2S → h2↑ + s0↓ (7)
Lokalizacja w naturze
Ten gaz jest naturalnie występujący w gorących źródłach siarkowych lub siarkowych, w gazach wulkanicznych, w ropie naftowej i gazu ziemnym.
 SUKTAJNE WODY MANANTICAL. Николай максимович [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons.
SUKTAJNE WODY MANANTICAL. Николай максимович [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons. Gdy ropa (lub gaz) zawiera znaczne ślady H2Mówi się, że jest „kwaśny”, w przeciwieństwie do „słodkiego”, czyli wtedy, gdy go nie zawiera.
Małe ilości h2S w ropie lub gazie są ekonomicznie szkodliwe, ponieważ należy zainstalować pralkę w celu jej usunięcia, zarówno w celu zapobiegania korozji, jak i zapewnienia resztkowego gazu bezpieczeństwa do użytku krajowego jako paliwa.
Występuje, gdy materia organiczna zawierająca siarkę jest rozkładana w warunkach beztlenowych (brak powietrza), takie jak ludzie, zwierzęta i odpady roślinne.
 Emisje H2S (niebieskawo zielony kolor) na wybrzeżu Namibii, sfotografowany przez NASA. Te emisje pochodzą z odpadów organicznych. Obserwatorium Ziemi NASA [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons.
Emisje H2S (niebieskawo zielony kolor) na wybrzeżu Namibii, sfotografowany przez NASA. Te emisje pochodzą z odpadów organicznych. Obserwatorium Ziemi NASA [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons. Bakterie obecne w jamie ustnej i w przewodzie pokarmowym wytwarzają je z degradowalnych materiałów, które zawierają warzywa lub białka zwierzęce.
Jego charakterystyczny zapach powoduje ostrzeganie jego obecności w zgniłych jajach.
H2S Występuje również w niektórych działaniach przemysłowych, takich jak rafinerie ropy, piece koksowe, fabryki papierowe, a także w przetwarzaniu żywności.
Synteza w ciele ssaków
H2S endogenny może wystąpić w tkankach ssaków, wśród tych ludzkich istot, dwiema ścieżkami, enzymatycznymi i nieenzymatycznymi.
Ścieżka nieenzymatyczna polega na zmniejszeniu elementarnej siarki S0 do h2S poprzez utlenianie glukozy:
2 c6H12ALBO6 (glukoza) + 6 s0 (siarka) + 3 godziny2O → 3 c3H6ALBO3 + 6 godz2S + 3 CO2 (8)
Może ci służyć: chlor: historia, właściwości, struktura, ryzyko, zastosowaniaŚcieżka enzymatyczna składa się z h h h2S z L-cysteiny, która jest aminokwasem syntetyzowanym przez organizm. Proces jest ubezpieczony przez kilka enzymów, takich jak cystyl.
 Kwas sulfhydowy został znaleziony w mózgu krów. Autor: Arttower. Źródło: Pixabay.
Kwas sulfhydowy został znaleziony w mózgu krów. Autor: Arttower. Źródło: Pixabay. Uzyskanie w laboratorium lub przemysłowo
Gaz wodoru (h2), a pierwiastki (y) siarki nie reaguje na normalne temperatury środowiskowe, ale powyżej nich zaczynają się łączyć, a optymalna temperatura wynosi 310 ° C.
Proces jest jednak zbyt wolny, więc do jego uzyskania stosowane są inne metody, wśród tych następujących.
Sulfidy metalu (takie jak siarczek żelazny) reagują z kwasami (takimi jak chlorowodor) w rozcieńczonym roztworze.
FES + 2 HCl → FECL2 + H2S ↑ (9)
W ten sposób otrzymuje się gaz2S, które, biorąc pod uwagę jego toksyczność, należy bezpiecznie zebrać.
Przemysłowe wykorzystanie H2S do produkcji siarki
Przechowywanie i transport w dużych ilościach h2S, który oddziela się od gazu ziemnego przez mycie aminami, jest trudny, więc proces Claus jest używany do zamieniającej go w siarkę.
 W rafineriach olejowych H jest oddzielone2S gazu ziemnego przez mycie aminami, a następnie staje się siarką. Autor: Satyaprem. Źródło: Pixabay.
W rafineriach olejowych H jest oddzielone2S gazu ziemnego przez mycie aminami, a następnie staje się siarką. Autor: Satyaprem. Źródło: Pixabay. W tym procesie występują dwie reakcje. W pierwszym h2S reaguje z tlenem, aby to dać2, Jak wspomniano powyżej (patrz reakcja 3).
Drugi to reakcja katalizowana przez tlenek żelaza, w którym SO2 jest zredukowane i h2S utlenia się, a dwie wytwarzają siarkę (patrz reakcja 6).
W ten sposób uzyskuje się siarkę, którą można łatwo przechowywać i transportować, a także przydzielić do wielu zastosowań.
Użyteczność lub znaczenie h2S endogenny w organizmie
H2E endogen jest tym, który występuje naturalnie w organizmie jako część normalnego metabolizmu u ludzi, ssaków i innych żywych istot.
Pomimo długiej reputacji bycia toksycznym i trującym gazem związanym z rozkładem materii organicznej, kilka ostatnich badań od 2000 roku do teraźniejszości ustaliło, że H2Endogen S jest ważnym regulatorem niektórych mechanizmów i procesów w życiu.
H2S przedstawia wysoką lipofilowość lub powinowactwo do tłuszczów, więc łatwo przecina błony komórkowe, penetrując wszystkie typy komórek.
Układu sercowo-naczyniowego
U ssaków kwas siarczkowy promuje lub reguluje serię sygnałów regulujących metabolizm, funkcję serca i przeżycie komórek.
Wywiera silny wpływ na serce, naczynia krwionośne i krążące pierwiastki krwi. Moduluje metabolizm komórkowy i funkcje mitochondriów.
Broni nerek szkód spowodowanych przez niedokrwienie.
Układ pokarmowy
Odgrywają ważną rolę jako czynnik ochronny przed uszkodzeniem błony śluzowej żołądka. Szacuje się, że jest ważnym mediatorem ruchliwości żołądkowo -jelitowej.
Jest prawdopodobne, że jest on zaangażowany w kontrolę wydzielania insuliny.
Ośrodkowy układ nerwowy
Działa również w ważnych funkcjach ośrodkowego układu nerwowego i chroni neurony stresu oksydacyjnego.
 Neurony są chronione przez H2S endogenny. Autor: Gerd Altmann. Źródło: Pixabay.
Neurony są chronione przez H2S endogenny. Autor: Gerd Altmann. Źródło: Pixabay. Szacuje się, że może chronić przed chorobami neurodegeneracyjnymi, takimi jak Parkinson, choroba Alzheimera i Hungintona.
Organ wizji
Chroń komórki fotoreceptorów przed zwyrodnieniem siatkówki indukowanej światłem.
Może ci służyć: węglan litowy (LI2CO3): Struktura, właściwości, zastosowaniaPrzeciw starzeniu się
H2S jest gatunkiem redukującym, może być spożywane przez różne środki utleniające krążące w organizmie. Walkalne gatunki utleniające, takie jak reaktywne formy tlenu i reaktywne gatunki azotu w organizmie.
Ogranicz reakcje wolnych rodników poprzez aktywację enzymów przeciwutleniających, które chronią przed skutkami starzenia się.
Potencjał uzdrawiający H2S dostarczany egzogenicznie
Biodostępność H2S Endogenna zależy od niektórych enzymów zaangażowanych w biosyntezę cysteiny u ssaków.
Niektóre badania sugerują, że don -dawca terapii leków2S może być korzystne dla niektórych patologii.
Na przykład może to być przydatne u pacjentów z cukrzycą, ponieważ zaobserwowano, że naczynia krwionośne zwierząt cukrzycowych poprawiają się wraz z lekami dostarczającymi h2S egzogenny.
H2S zapewniło egzogennie zwiększa angiogenezę lub tworzenie naczyń krwionośnych, dzięki czemu może służyć do leczenia przewlekłych chorób niedokrwiennych.
Opracowywane są narkotyki, które mogą uwolnić H2Jest powoli, aby móc korzystać z różnych chorób. Jednak skuteczność, bezpieczeństwo i mechanizmy ich działania muszą być nadal badane.
Ryzyko
H2S jest śmiertelną trucizną, jeśli jest wdychana czysta, a nawet rozcieńczona 1 część gazu w 200 części powietrza. Ptaki są bardzo wrażliwe na h2I umrzeć nawet w rozcieńczeniu 1 na 1500 części powietrza.
 Kwas siarczkowy lub siarkowodór H2S jest potężną trucizną. Autor: Openicons. Źródło: Pixabay.
Kwas siarczkowy lub siarkowodór H2S jest potężną trucizną. Autor: Openicons. Źródło: Pixabay. H2S jest potężnym inhibitorem niektórych enzymów i utleniających procesów fosforylacji, co prowadzi do uduszenia komórek. Większość ludzi postrzega to w stężeniach większych niż 5 ppb (części na miliard). Stężenia 20-50 ppm (części na milion) są irytujące dla oczu i dróg oddechowych.
Wdychanie 100-250 ppm przez kilka minut może generować brak koordynacji, zaburzenia pamięci i zaburzenia motoryczne. Gdy stężenie wynosi około 150-200 ppm2S. Jeśli stężenie 500 ppm jest wdychane przez 30 minut, można wytworzyć obrzęk płuc i zapalenie płuc.
Stężenia ponad 600 ppm mogą być śmiertelne w ciągu pierwszych 30 minut, ponieważ układ oddechowy jest sparaliżowany. A 800 ppm to stężenie, które jest natychmiast śmiertelne dla człowieka.
Dlatego należy unikać, że występują H -ucieczki2S w laboratoriach, lokalnych lub w dowolnym miejscu lub sytuacji.
Ważne jest, aby ostrzec, że wiele zgonów ma miejsce, ponieważ ludzie wchodzą w przestrzenie ograniczone do ratowników lub członków rodziny, którzy upadli z powodu zatrucia H2S, też ich umieram.
To łatwopalny gaz.
Bibliografia
- Panthi, s. i in. (2016). Fizjologiczne znaczenie siarkowodoru: wschodzący neuroprotektor i neuromodulator. Medycyna oksydacyjna i długowieczność komórkowa. Tom 2016. Identyfikator artykułu 9049782. Hyndawi wyzdrowiał.com.
- Shefa, u. i in. (2018). Funkcje sygnalizacyjne przeciwutleniające i komórkowe siarkowodoru w ośrodkowym układzie nerwowym. Medycyna oksydacyjna i długowieczność komórkowa. Tom 2018. ID artykułu 1873962. Hyndawi wyzdrowiał.com.
- Tabassum, r. i in. (2020). Znaczenie terapeutyczne siarkowodoru w chorobach neurodegeneracyjnych związanych z wiekiem. Neural Regen Res 2020; 15: 653-662. Nrronline odzyskała.org.
- Martelli, a. i in. (2010). Siarkowodór: nowatorska okazja do odkrywania narkotyków. Przegląd badań leczniczych. Tom 32, wydanie 6. Pobrano z biblioteki online.Wiley.com.
- Wang, m.-J. i in. (2010). Mechanizmy angiogeza: rola siarkowodoru. Farmakologia kliniczna i eksperymentalna i fizjologia (2010) 37, 764-771. Pobrano z biblioteki online.Wiley.com.
- Dalefield, r. (2017). Dym i inne wdychane toksyczne. Siarkowodór. W toksykologii weterynaryjnej dla Australii i Nowej Zelandii. Odzyskane z naukowym.com.
- Selley, R.C. i Sonnenberg, s.DO. (2015). Właściwości fizyczne i chemiczne ropy naftowej. Siarkowodór. W Elements of Petroleum Geology (wydanie trzecie). Odzyskane z naukowym.com.
- Hocking, m.B. (2005). Siarka i kwas siarkowy. Proces CLAUS Konwersja siarkowodoru do siarki do siarki. W Handbook of Chemical Technology and Control Control (trzecie wydanie). Odzyskane z naukowym.com.
- LEFER, D.J. (2008). Potencjalne znaczenie zmian w siarku wodorowym (h2S) Biodostępność w cukrzycy. British Journal of Pharmacology (2008) 155, 617-619. Pobrano z BPSPUBS.Biblioteka online.Wiley.com.
- LUB.S. National Library of Medicine. (2019). Siarkowodór. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov.
- Port, J.DO. i Ibarz, j. (1965). Nowoczesna chemia ogólna. 7. edycja. Marín Editorial, S.DO.
- « Pochodzenie edukacji socjalistycznej, cechy, zasady, przykłady
- Neoklasyczna historia teatru, cechy, przedstawiciele, prace »

