Właściwości cyjanku potasu (KCN), zastosowania, struktury, ryzyko,

- 4141
- 1296
- Estera Wojtkowiak
On Cyjanek potasu Jest to związek nieorganiczny utworzony przez jonowy potas k+ i jon cyjanku CN-. Jego formuła chemiczna to kcn. Jest to krystaliczna biała stała, wyjątkowo trująca.
KCN jest bardzo rozpuszczalny w wodzie, a podczas rozpuszczania się jest hydrolizowany, tworząc kwas cyjanhydowy lub cyjankowy HCN, który jest również bardzo trujący. Cyjan potasowy może tworzyć złożone sole ze złotem i srebrem, dzięki czemu został użyty do wydobywania tych metali szlachetnych z niektórych minerałów.
 Stały cyjanek potasowy KCN. Morienus (przesłane przez DE: Benutzer: Bxxxd z: wiki) [cc by-sa 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons.
Stały cyjanek potasowy KCN. Morienus (przesłane przez DE: Benutzer: Bxxxd z: wiki) [cc by-sa 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons. KCN służy do pokrycia tanich metali złotem i srebrem poprzez proces elektrochemiczny, to znaczy metoda, w której prąd elektryczny jest przepuszczany przez roztwór zawierający sól złożoną z metalu szlachetnego, cyjanku i potasu.
Cyjanek potasu, ponieważ zawiera cyjanek musi być manipulowany z wielką ostrożnością, z odpowiednimi narzędziami. Nigdy nie należy go odrzucić do środowiska, ponieważ jest również bardzo toksyczne dla większości zwierząt i roślin.
Jednak badane są metody stosujące wspólne glony w celu usunięcia zanieczyszczonego cyjanku potasu z niskimi stężeniami tego.
[TOC]
Struktura
KCN jest związkiem jonowym utworzonym przez kation potasowy k+ i cyjankowy anion CN-. W tym atom węgla jest powiązany z atomem azotu przez potrójne kowalencyjne wiązanie.
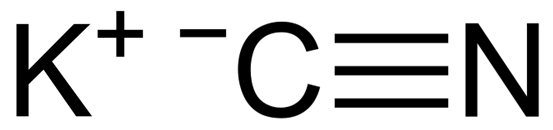 Struktura chemiczna cyjanku potasu KCN. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Struktura chemiczna cyjanku potasu KCN. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. W cyjanku stałego potasu anion CN- Może swobodnie obracać się przez to, co zachowuje się jak sferyczny anion, w konsekwencji kryształ KCN ma strukturę sześcienną podobną do struktury chlorku potasu KCL.
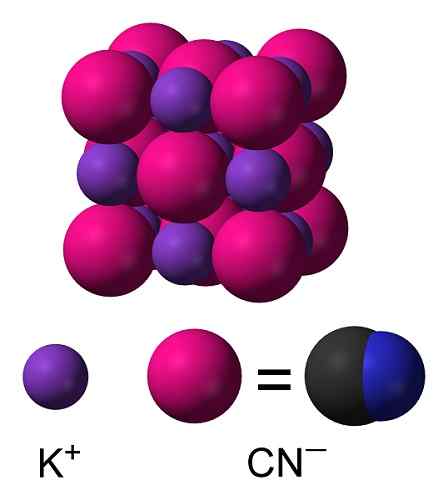 Struktura krystaliczna KCN. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Struktura krystaliczna KCN. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
- Cyjanek potasu
- Cyjanek potasu
- Cianopotasio
Nieruchomości
Stan fizyczny
Biała krystaliczna stała. Kryształy sześcienne.
Waga molekularna
65 116 g/mol.
Temperatura topnienia
634,5 ° C
Może ci służyć: siarczan glinu (AL2 (SO4) 3)Punkt wrzenia
1625 ° C.
Gęstość
1,55 g/cm3 w 20 ° C.
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 716 g/l w 25 ° C i 100 g/100 ml wody w 80 ° C. Nieco rozpuszczalny w metanolu: 4,91 g/100 g metanolu w 19,5 ° C. Bardzo mało rozpuszczalny w etanolu: 0,57 g/100 g etanolu w 19,5 ° C.
Ph
Wodny roztwór 6,5 g KCN w 1 l wody ma pH 11,0.
Stała hydrolizy
KCN jest bardzo rozpuszczalny w wodzie. Kiedy jon cyjanku CN jest wolny- który przyjmuje proton h+ wody z tworzeniem kwasu cyjanhydowego HCN i uwalniania jonu OH-:
Cn- + H2O → HCN + OH-
Stała hydrolizy wskazuje trend, z jaką przeprowadzana jest wspomniana reakcja.
KH = 2,54 x 10-5
Roztwory wodne KCN uwalniają środowisko cyjankowodoru HCN, gdy ogrzewają 80 ° C.
Właściwości chemiczne
Nie jest łatwopalne, ale gdy stały KCN jest podgrzewany, dopóki jego rozkład nie emituje bardzo toksycznego cyjanoru HCN, tlenki azotu nieX, K -POTASUS Tlenek2O i tlenek węgla.
KCN reaguje ze złotymi solami tworzącymi potas aurocianuro kau (CN)2 i potasu auricianUro Kau (CN)4. To są kompleksy bezbarwne sole. Ze srebrnym metalowym AG KCN tworzy argentocyjanek potasu Kag (CN)2.
Jon cyjanku KCN reaguje z niektórymi związkami organicznymi, które mają halogen (takie jak chlor lub brom) i zajmuje ich miejsce. Na przykład reaguje z kwasem bromooctowym, aby podać kwas cyjanooctowy.
Inne właściwości
Jest higroskopijny, pochłania wilgoć środowiska.
Ma miękki zapach gorzkich migdałów, ale nie jest to wykryte przez wszystkich ludzi.
Uzyskanie
KCN jest wytwarzany przez reakcję wodorotlenku potasu KOH w roztworze wodnym z cyjankiem wodoru HCN. Ferrocyjanin potasowy K jest również uzyskiwany przez ogrzewanie4Wiara (CN)6:
K4Wiara (CN)6 → 4 kcn + 2 c + n2↑ + Wiara
Użyj w metalowej elektrodzie
Jest stosowany w procesie pokrycia małych cennych metali złotem i srebrem. Jest to proces elektrolityczny, to znaczy energia elektryczna przechodzi przez wodny roztwór z odpowiednimi solami.
Może ci służyć: trójtlenek siarki (SO3): struktura, właściwości, ryzyko, użyciaSrebro
Stosuje się argentocyjanin potasowy KAG (CN)2 Do powlekania tańszymi metaliami (AG).
Są one umieszczone w wodnym roztworze KAG potasu (CN)2, Gdzie dodatnia anoda lub słup jest czystym srebrnym prętem (AG), a katoda lub słup ujemny jest tanim metalem, który ma srebrny metal.
Gdy prąd elektryczny przechodzi przez roztwór, srebro jest osadzane na drugim metalu. Gdy stosowane są sole cyjanku, warstwa srebrna jest osadzana w drobniejszy, bardziej zwarty i przylegający sposób niż w roztworach innych związków.
 Niektóre przedmioty biżuterii są pokryte srebrem za pomocą soli KCN. Autor: Stocksnap. Źródło: Pixabay.
Niektóre przedmioty biżuterii są pokryte srebrem za pomocą soli KCN. Autor: Stocksnap. Źródło: Pixabay. Złoto
Podobnie w przypadku złota (AU), Aurocyjan potasowy Kau (CN)2 i potasu auricianUro Kau (CN)4 Inne metale są używane do elektrolitycznie brązowego.
 Złącza elektryczne pokryte złotem prawdopodobnie za pomocą soli KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Złącza elektryczne pokryte złotem prawdopodobnie za pomocą soli KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Inne zastosowania
Niektóre inne zastosowania cyjanku potasowego są wspomniane poniżej.
- W przypadku procesu przemysłowego stali stali azotorowej (dodanie azotu).
- Do czyszczenia metalu.
- W procesach drukowania i fotografii.
- Wcześniej był używany do ekstrakcji złota i srebra z minerałów, które je zawierają, ale potem został zastąpiony cyjankiem sodu, który jest tańszy, choć równie toksyczny.
- Jako owadobójstwo na fumigację drzew, statków, samochodów kolejowych i magazynów.
- Jako odczynnik w chemii analitycznej, to znaczy do analizy chemicznej.
- Aby przygotować inne związki chemiczne, takie jak barwniki i barwniki.
 Ekstrakcja złota w Południowej Afryce w 1903 roku przy użyciu KCN to, co było w śmiertelnym zanieczyszczeniu otaczającego środowiska. Argyll, John Douglas Sutherland Campbell, książę, 1845–1914; Creswicke, Louis [Bez ograniczeń]. Źródło: Wikimedia Commons.
Ekstrakcja złota w Południowej Afryce w 1903 roku przy użyciu KCN to, co było w śmiertelnym zanieczyszczeniu otaczającego środowiska. Argyll, John Douglas Sutherland Campbell, książę, 1845–1914; Creswicke, Louis [Bez ograniczeń]. Źródło: Wikimedia Commons. Ryzyko
KCN jest bardzo trującym związkiem dla zwierząt i większości roślin i mikroorganizmów. Jest klasyfikowane jako super toksyczne. Nadal jest śmiertelne w bardzo małych ilościach.
Może ci służyć: chlorek niklu (NICL2): struktura, właściwości, uzyskiwanie, użyciaJego szkodliwy efekt może wystąpić przez wdychanie, kontakt z skórą lub oczami lub spożycie. Hamuje wiele procesów metabolicznych, zwłaszcza białek krwi, które uczestniczą w transporcie tlenu, takich jak hemoglobina.
Wpływa na narządy lub systemy bardziej wrażliwe na brak tlenu, takie jak ośrodkowy układ nerwowy (mózg), układ sercowo -naczyniowy (serce i naczynia krwionośne) i płuca.
 Cyjanek potasowy to trucizna. Autor: Clker-Free-Vector-Images. Źródło: Pixabay.
Cyjanek potasowy to trucizna. Autor: Clker-Free-Vector-Images. Źródło: Pixabay. Mechanizm akcji
KCN zakłóca zdolność organizmu do stosowania tlenu.
Cyjankowy jon cn- KCN ma wielkie powinowactwo do wiary wiary żelazowej3+, Co oznacza, że gdy wchłania cyjankiem szybko reaguje z wiarą3+ Krew i tkanki.
W ten sposób zapobiega oddychaniu komórek, które wchodzą w stan braku tlenu, ponieważ chociaż próbują oddychać, nie mogą go użyć.
Występuje następnie przejściowy stan hipperapnea (zawieszenie oddechowe) i ból głowy, a wreszcie śmierć przez zatrzymanie oddechu.
Dodatkowe ryzyko
Podczas ogrzewania wytwarza bardzo toksyczne gazy, takie jak HCN, tlenki azotuX, K -POTASUS Tlenek2O i tlenek węgla.
Po kontakcie z wilgocią HCN, która jest wysoce łatwopalna i bardzo toksyczna.
KCN jest również bardzo trujący dla organizmów wodnych. Nigdy nie należy go odrzucić do środowiska, ponieważ zanieczyszczenie wody może wystąpić tam, gdzie piją zwierzęta i zamieszkują ryby.
Istnieją jednak bakterie, które wytwarzają cyjanku, takie jak Chromobacterium voolateum i niektóre gatunki Pseudomonas.
Ostatnie badania
Niektórzy badacze odkryli, że zielone glony Chlorella vulgaris Można go stosować do leczenia zanieczyszczonych wód z cyjankiem potasu KCN w niskich stężeniach.
Glony były w stanie skutecznie usunąć KCN, ponieważ w niskich ilościach stymulowało wzrost glonów, ponieważ aktywowały wewnętrzny mechanizm, aby odpierać toksyczność KCN.
Oznacza to, że glony Chlorella vulgaris Może potencjalnie usunąć cyjanku i że można zaprojektować skuteczną metodę biologicznego traktowania zanieczyszczenia cyjankiem.
 Zdjęcie glonów Chlorella vulgaris obserwowane w mikroskopie. JA: Użytkownik: Neon / Użytkownik: Neon_ja [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Zdjęcie glonów Chlorella vulgaris obserwowane w mikroskopie. JA: Użytkownik: Neon / Użytkownik: Neon_ja [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Bibliografia
- LUB.S. National Library of Medicine. (2019). Cyjanek potasu. National Center for Biotechnology Information. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Coppock, r.W. (2009). Zagrożenia dla dzikiej przyrody przez środki chemiczne. W Handbook of Toxicology of Chemical Warfare Agents. Odzyskane z naukowym.com.
- Liu, q. (2017). Ocena usuwania cyjanku potasu i jego toksyczności u zielonych glonów (Chlorella vulgaris). Byki środowisko zanieczyszczenia toksykalu. 2018; 100 (2): 228-233. NCBI odzyskało.NLM.Nih.Gov.
- Narodowy Instytut Bezpieczeństwa i Zdrowia Pracy (NIOSH). (2011). Cyjanku potasu: środek systemowy. CDC odzyskało.Gov.
- Alvarado, L.J. i in. (2014). Odkrycie ryboswitch, struktura i funkcja. Synteza uracylu. W metodach enzymologii. Odzyskane z naukowym.com.
- « Struktura Tripolifosforan Sodu (Na5P3O10), właściwości, zastosowania, uderzenie
- Ponieważ jestem bardzo śpiący? 9 przyczyn i rozwiązań »

