Węglan sodu (NA2CO3)
- 3750
- 1044
- Gabriela Łuczak
Wyjaśniamy, czym jest węglan sodu, jego właściwości fizyczne i chemiczne, struktura i zastosowania
 Struktura i wzór węglanu sodu
Struktura i wzór węglanu sodu Co to jest węglan sodu?
On węglan sodu (Na2WSPÓŁ3) Jest to sól nieorganiczna, metal alkaliczny i kwas węglowy. Jest również znany na całym świecie jako Sosa Ash. Jeziora i aktywność wulkaniczne wzbogacono gleby sodu, z których rośliny zostały odżywione; Następnie, po pożarze, rośliny te rozprzestrzeniają popioły węglanowe.
Jak powstaje ta metaliczna sól sodu? Czysty sód ma konfigurację Valencia [NE] 3S1. Elektron orbitalny 3S1 Jest łatwo odłączany przez inne elementy natury (takie jak siarka, tlen, chlor, fluor itp.), tworząc związki mineralne, w których uczestniczy stabilny jon na+.
Następnie+ Towarzyszy mu inne gatunki jonowe w tych stałych; Spośród nich węglan sodu ma tylko jeden obecny w naturze. Od tego czasu użyto we wszystkich cywilizacjach przez cały czas. Te cywilizacje stwierdzały w tym, że są korzystne dla szarego pyłu dla swoich domów i ludzi.
Te właściwości oznaczały ich zastosowania, które dziś utrzymują tradycyjne aspekty przeszłości, a inne spełniają obecne potrzeby.
Węglan sodu ma bardzo obfity charakter, a być może także na innych terytoriach poza planetą Ziemią, takimi jak niektóre księżyce układu słonecznego.
Formuła
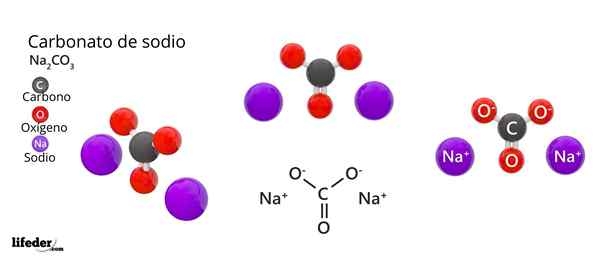
Chemiczna wzór węglanu sodu to Na2WSPÓŁ3. Jak to jest interpretowane? Oznacza to, że w krystalicznym stałym stałym dla każdego CO -ion32- Istnieją dwa jony NA+.
Struktura węglanu sodu
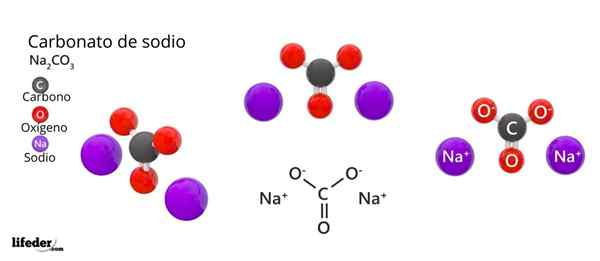
Na górnym obrazie reprezentowana jest struktura Na2WSPÓŁ3 Bezwodnik (zwany także sosa caltinada). Fioletowe kule odpowiadają jonom Na+, podczas gdy czarny i czerwony do jonów32-.
Jony węglanowe mają płaską strukturę trygonalną, z atomami tlenu na ich wierzchołkach.
Może ci służyć: kwas kinowy: struktura, właściwości, uzyskiwanie, zastosowaniaObraz daje panoramę widzianą z wyższej płaszczyzny. Jony NA+ Są otoczone sześcioma atomami tlenu, od CO -ions32-. To znaczy w Na2WSPÓŁ3 Bezwodnik sód spełnia oktaedralną geometrię koordynacji (jest zamknięty w środku oktaedronu).
Jednak ta struktura jest również w stanie pomieścić cząsteczki wody, oddziałując z mostami wodorowymi z wierzchołkami trójkątów.
W rzeczywistości hydraty na2WSPÓŁ3 (Na2WSPÓŁ3· 10H2Lub na2WSPÓŁ3· 7H2Lub na2WSPÓŁ3· H2Lub i inne) mają większą obfitość niż sól anhydridowa.
Termonatryt (na2WSPÓŁ3· H2O), natron (na2WSPÓŁ3· 10H2O) i Trona (na3(HCO3)(WSPÓŁ3) · 2H2Lub są głównymi naturalnymi źródłami węglanu sodu, zwłaszcza minerału Trona, reprezentowanych na pierwszym zdjęciu.
Używa/zastosowania węglanu sodu
Węglan sodu wypełnia liczne funkcje u ludzi, gospodarstw domowych i przemysłu, wśród tych funkcji wyróżniają się następujące:
- Węglan sodu jest stosowany w wielu produktach czyszczących. Wynika to z jego zdolności dezynfekujących, mocy do rozpuszczania tłuszczów i ich własności do zmiękczenia wody. Jest częścią detergentów używanych w pralni, automatycznej zmywarce, czystej szkła, mieszaniu plam, trybuny itp.
- Dezinfekt węglanowy może być stosowany na twardych powierzchniach, takich jak podłogi, ściany, porcelana i wanny, z wyjątkiem Włókno szklane i aluminium, które może być przez niego porysowane.
- Jest używany w niektórych produktach, aby uniknąć w tym w babeczkach.
- Jest obecny w kilku produktach do higieny osobistej, takich jak kąpiele bąbelkowe, makaron dentystyczny i mydła.
- Jest stosowany w branży szklanej ze względu na jego zdolność do rozkładania krzemianów.
- Jest używany w utrzymaniu basenów, gdzie wypełnia funkcję dezynfekującą i regulacyjną pH.
- U ludzi terapeutycznie stosowane w leczeniu kwasowości i zapalenia skóry.
- W medycynie weterynaryjnej jest stosowany w leczeniu grzybicy i czyszczenia skóry.
Synteza węglanu sodu

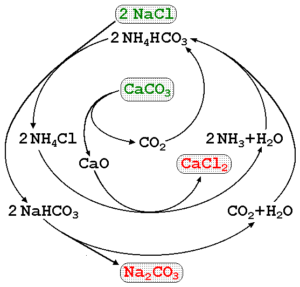
Węglan sodu można wytwarzać za pomocą solanki z morza i wapienia (CACO3) W procesie Solvay. Na obrazie wyższym ilustrując schemat procesu wskazujący na drogi produkcyjne, a także odczynniki, pośredniki i produkty. Odczynniki są pisane zielonymi literami, a produkty z czerwonymi literami.
Monitorowanie tych reakcji może być nieco skomplikowane, ale globalne równanie wskazujące tylko odczynniki i produkty to:
2nacl (aq) + caco3(s) na2WSPÓŁ3(s) + cacl2(AC)
Kako3 Ma bardzo stabilną strukturę krystaliczną, więc nieustannie wymaga dużo energii, aby ją rozłożyć w CO2. Ponadto proces ten generuje duże ilości CACL2 (chlorek wapnia) i inne zanieczyszczenia, których zrzuty wpływają na jakość wody i środowiska.
Istnieją również inne metody produkcji węglanu sodu w dziedzinach przemysłowych, takie jak procesy Hou i LeBlanc.
Dziś uzyskiwanie z naturalnych minerałów jest zrównoważone, a Trona jest najbardziej obfita z nich.
Z drugiej strony najbardziej tradycyjna metoda polegała na uprawie i spalaniu roślin i glonów bogatych w sód. Następnie popioły kąpano z wodą i poddawano ogrzewaniu, aż produkt. Stąd pojawił się słynne popioły Sosy.
Właściwości węglanu sodu
Następnie2WSPÓŁ3 Jest to higroskopijna biała stała, toaleta o masie cząsteczkowej 106 g/mol i gęstości 2,54 g/ml w 25 ° C.
Jego właściwości zmieniają się, gdy cząsteczka wody zawiera w jej strukturze krystalicznej. Ponieważ woda może tworzyć mosty wodorowe i jony „otwartą przestrzeń” między nimi, objętość szkła wzrasta, a gęstość hydratu maleje. Na przykład dla Na2WSPÓŁ3· 10H2Lub jego gęstość wynosi 1,46 g/ml.
Może ci służyć: odwracalna reakcja: charakterystyka i przykładyNastępnie2WSPÓŁ3 topi się przy 851 ° C, rozkładając się zgodnie z następującym równaniem:
Na2WSPÓŁ3(s) => na2Lub (S) + CO2(G)
Ponownie, pomimo jonów32- i na+ Różnią się rozmiarami, ich interakcje elektrostatyczne są bardzo wydajne i utrzymują stabilną sieć krystaliczną.
Cząsteczki wody „utrudniają” te interakcje, w wyniku czego hydraty są bardziej podatne na rozkład niż bezwodnik.
To podstawowa sól; to znaczy, rozpuszczone w wodzie wytwarza roztwór o pH większym niż 7. Wynika to z hydrolizy CO32-, którego reakcja uwalnia OH- pośrodku:
WSPÓŁ32-(AC) + H2Lub (L) HCO3-(AC) + OH-(AC)
Jest bardzo rozpuszczalny w rozpuszczalnikach wodnych i polarnych, takich jak glicerolu, gliceryna, aceton, octany i ciekł amoniak.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. W elementach grupy 1. (Czwarta edycja., P. 265). MC Graw Hill.
- Scifun.org. (2018). Węglan wodoru sodu i węglan sodu. Odzyskany z Scifun.org
- Wikipedia. (2018). Węglan sodu. Odzyskane z.Wikipedia.org
- Pubchem. (2018). Węglan sodu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov
- Ciner Resources Corporation. (2018). Soda Ash. Ciner wyzdrowiał.nas.com
- Peltier k. (3 lipca 2018 r.). Wszystko, co musisz wiedzieć o karbonicie sodu. Pobrano 8 kwietnia 2018 r. Z: THESPRUCE.com
- Branże netto. (2018). Węglan sodu - zastosowania węglanu sodu. Pobrano 8 kwietnia 2018 r. Z: Science.Jank.org

