Ciepło
- 1457
- 225
- Herbert Wróblewski
Co to jest utajone ciepło?
Utrzymujące ciepło to ilość ciepła, które musi wchłonąć lub odłączyć substancję, aby zmienić stan fizyczny lub fazę, utrzymując stałą temperaturę podczas tego procesu. Zapewnione lub uwalniane ciepło nie jest manifestowane, nie „czuje się” jak zwykle w zmienności temperatury; Stąd termin utajonego ciepła.
Utrzymujące słowo pochodzi od łacińskiego słowa „latenn”, co oznacza ukryte, więc utajone ciepło zachowuje się tak, jakby nie istniało, gdy temperatura jest stała. Ale jest: to, co się dzieje.
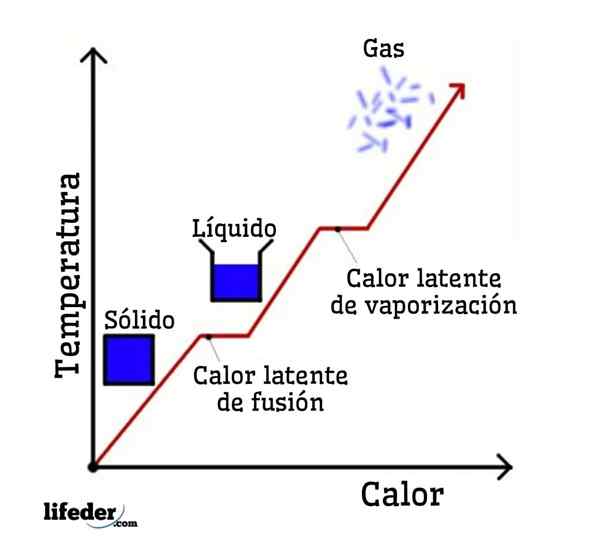
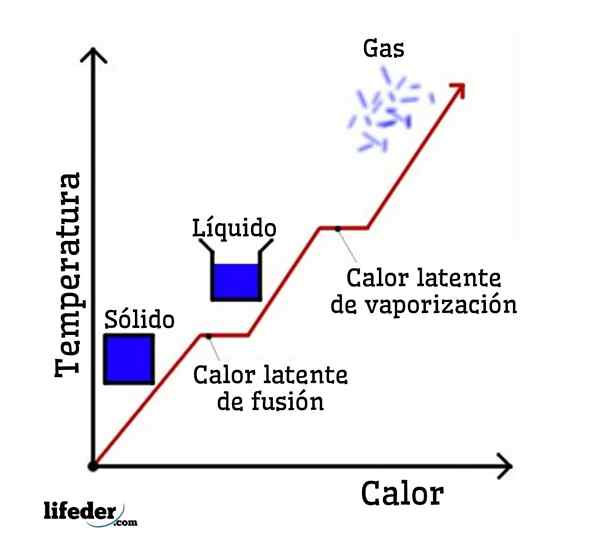
Jeśli woda jest przyjmowana jako przykład, zmiany fazowe są następujące: lód (stały) topi się w ciekłej (cieczowej) wodzie w procesie zwanym fuzji; i z kolei ciekła woda odparowuje, aby przekształcić się w pary wodne (gaz) w proces zwany parą.
Z drugiej strony para wodna jest chłodzona do ciekłej wody w procesie zwanym kondensacją; a płynna woda znów staje się lodem w procesie zwanym zestalaniem.
Każda z tych zmian faz ma utajone ciepło, które może być dodatnie (wchłanianie) lub ujemne (uwalnianie).
Utrzymujące ciepło topnienia
 Zmienia się z stałego na ciecz; połączenie
Zmienia się z stałego na ciecz; połączenie Jest to ilość ciepła, które należy dostarczyć do pewnej ilości substancji stałej, aby zmienić jej stan fizyczny z stałego na ciekłe. Podczas fuzji nie ma zmiany temperatury, więc podczas gdy ciał stałego jest założony lub stopi się, wytwarzana z niej ciecz ma taką samą temperaturę jak cała substancja stała.
Zasadniczo ciepło to jest określone w normalnym punkcie fuzji, czyli temperaturze, w której stałe zaczyna scalanie pod ciśnieniem atmosferycznym. W tej temperaturze występuje jednoczesna równowaga lub obecność w tym samym czasie stanu stałego i stanu ciekłego.
Może ci służyć: zmienna kategorialna: cechy i przykładyStan stały charakteryzuje się obecnością zwartej struktury ze względu na istnienie dużych wiązań chemicznych, które nadają mu sztywność strukturalną. W przypadku transformacji stałego do cieczy interakcje te muszą zostać zepsute, więc są zużyte (wchłaniane) energię w tym celu.
Typowym przykładem jest spożywane lody, tworzone przez wodę, cukier i inne substancje. Często obserwuje się, że lody, jeśli nie są szybko spożywane, zaczynają się topić, to znaczy topić. Dzieje się tak, gdy temperatura lodów osiąga punkt topnienia lodu.
Przykłady
Wymienione zostaną niektóre przykłady utajonych ciepła fuzyjnego wyrażonych w J/G; to znaczy energia, którą gram stałego musi wchłonąć, aby stopić się w temperaturze topnienia:
-Ice 334.0
-380 Aluminium.0
-Siarka 38.1
-Miedź 134.0
-Etanol 104.0
-Merkury 11.8
-Złot 64.5
-Silver 80.3
-Prowadzenie 24.5
-Tungsten 184
Lód wchłania bardzo ciepło, nie dlatego, że jego interakcje są silniejsze, ale dlatego, że jest w stanie wyjątkowo rozproszyć ciepło między jego kryształami.
Utajone ciepło waporyzacji
Jest to ilość ciepła, które pochłania pewną ilość substancji do przemieszczania się ze stanu ciekłego do stanu gazowego w normalnej temperaturze wrzenia. To znaczy ciepło, które ciecz pochłania, gdy się gotuje i staje się gazem bez wzrostu temperatury.
W łonie płynu cząsteczki substancji mogą oddziaływać z tworzeniem mostów wodorowych i dla sił przyciągania między cząsteczkami. Aby przekazać substancję ze stanu ciekłego do stanu gazowego, musisz przezwyciężyć te siły, więc musisz dostarczyć ciepło.
Wrażliwe ciepło staje się tym, które pochłania ciecz tylko w celu zwiększenia jej temperatury, co będzie zależeć od jej ciepła właściwego. Tymczasem utajone ciepło waporyzacji służy do przekształcenia go bezpośrednio w parę, co jest znacznie łatwiejsze w temperaturze wrzenia.
Może ci służyć: krzywa kalibracji: po co to zrobić, jak to zrobić, przykładyPrzykłady
Poniżej znajdują się przykłady niektórych cieczy z ich utajonymi cieplami parowania wyrażonego ponownie w J/G:
-Kwas octowy 402
-Aceton 518
-Woda 2256
-Alkohol etylowy 846
-Siarka 1510
-Benzen 390
-Dwutlenek węgla 574
-Chlor 293
-Eter 377
-Gliceryna 974
-Merkury 295
-Tlen 214
Zwróć uwagę, że ogromne ukryte ciepło ciekłej wody: 1 g ciekłej wody (około 1 ml) musi wchłonąć 2256 J, aby odparować. Ciekła woda nadal rozprasza ciepło, które otrzymuje znacznie lepiej w porównaniu z lodem.
Uczciwy sposób zestalania
Jest to ciepło, które musi odłączyć pewną ilość substancji, aby przejść od jej stanu ciekłego do stanu stałego w punkcie zestalania lub zamrażania. Ponownie, dopóki ciecz nie się nie utrannie, temperatura pozostanie stała.
Proces zestalania jest odwrotny w stosunku do procesu połączenia, więc wartości utajonego ciepła zestalania i wartości utajonego ciepła fuzji są równe, ale przeciwnych znaków.
Cząsteczki substancji w stanie ciekłym poruszają się z pewną swobodą ze względu na energię, którą mają. Dlatego, aby przejść do fazy stałej, cząsteczki muszą uwalniać energię w postaci ciepła, co umożliwia większą interakcję między cząsteczkami substancji.
Interakcja między cząsteczkami sprzyja tworzeniu się wiązań chemicznych fazy stałej. Przykład tego występuje, gdy w pojemnikach w pojemnikach w lodówce w lodówce w lodówce umieszcza się płynną wodę. Zamrażarka wydobywa ciepło z ciekłej wody i jest zestalona, aby stać się lodem.
Przykłady
Poniżej kilka przykładów ukrytych ciepła zestalania (w J/G) dla niektórych cieczy:
Może ci służyć: biała dziura: historia, teoria i sposób jej powstania-Woda (-334)
-Aluminium (-380)
-Siarka (-38)
-Miedź (-134)
-Etanol (-104)
Uławne ciepło kondensacji
Jest to ilość ciepła, które należy zwolnić lub zwolnić z pewnej ilości substancji, aby przejść ze stanu gazu do stanu ciekłego. Gaz, który jest skondensowany, a utworzona ciecz utrzymuje tę samą temperaturę podczas kondensacji.
Kondensacja jest procesem sprzecznym z waporyzacją. Utrzymujące ciepło kondensacyjne ma taką samą wartość jak utajone ciepło parowania, ale z przeciwnym znakiem i w punkcie wrzenia. Przykładem tego jest to, że jest ugotowany, a para jest skondensowana w wewnętrznej powierzchni doniczek.
Cząsteczki gazowe poruszają się swobodnie napędzane przez energię, którą mają. Dlatego muszą uwolnić energię, aby umożliwić ustanowienie międzycząsteczkowych interakcji stanu ciekłego między cząsteczkami substancji.
W naturze istnieje wiele innych przykładów zjawiska kondensacji wody. Pary wodne wznosi się w atmosferze i kondensuje się w chmurach w postaci kropli wody.
Istnieje również obecność kropelek wody w szklance samochodów, produkt kondensacji wody z powodu spadku temperatury we wczesnym ranku, stanowiącym Rocío, stanowiącego Rocío.
Przykłady
Wreszcie, ich odpowiednie ciepło kondensacyjne ponownie wyrażone, w J/G: zostaną wymienione na niektóre opary:
-Kwas octowy (-402)
-Aceton (-518)
-Woda (-2256)
-Alkohol etylowy (-846)
-Siarka (-1510)
-Benzen (-390)
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Czwarta edycja, Longmans.
- Wikipedia. (2020). Ciepło. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (2020). Ciepło. Odzyskane z: Britannica.com
- Przybór inżynierski. (2003). Płyny: utajone ciepło parowania. Pobrano z: EngineeringToolbox.com
- Uczenie się lumen. (S.F.). Zmiana fazowa i ciepło ranne. Odzyskane z: kursów.Lumenarning.com

