Równoważenie równań chemicznych
- 2730
- 447
- Gabriela Łuczak
Jakie jest równoważenie równań chemicznych?
Równoważenie równań chemicznych jest operacją matematyczną, która jest przeprowadzana w celu utrzymania prawa ochrony materii w reakcjach. Materia nie jest tworzona ani zniszczona. Dlatego liczba atomów przed i po reakcji chemicznej musi być taka sama, zarówno w odczynach, jak i w produktach.
Aby zrównoważyć równanie chemiczne, musisz policzyć atomy przed i po strzałce. Jeśli liczby się pokrywają, oznacza to, że reakcja jest zrównoważona. W przeciwnym razie konieczne będzie dopasowanie tych liczb poprzez modyfikację współczynników stechiometrycznych według prób i błędów, jest to najprostsza i najbardziej intuicyjna metoda równowagi.
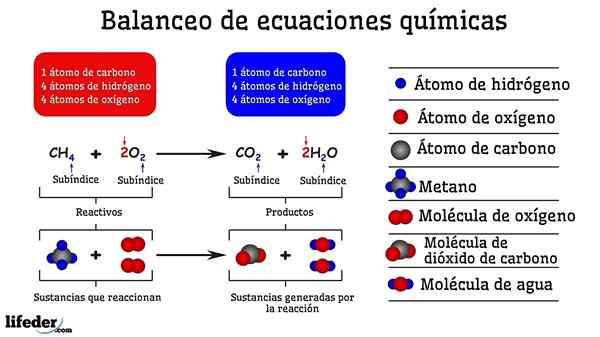
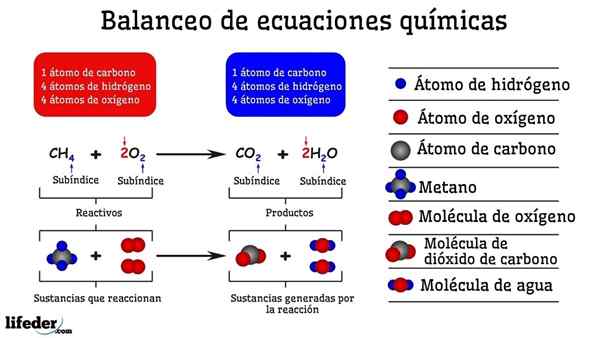 Przykład bilansowania chemicznego reakcji między metanem a dwiema cząsteczkami tlenu
Przykład bilansowania chemicznego reakcji między metanem a dwiema cząsteczkami tlenu Gdy jest zrównoważony próbą i błędem, jest tak, jakby zostały usunięte lub dodane atomy w jednej z dwóch stron subbaje. Dopóki subbaja nie zostanie zawieszona w poziomie, równanie chemiczne nie będzie całkowicie zrównoważone. Po żadnych stronach nie może więcej (stwórz materię) lub mniej atomów (zniszczyć materię).
Łatwe równoważące przykłady równań
W poniższych przykładach zobaczysz zrównoważone lub łatwe do zrównoważenia równania chemiczne. Wszystko musi mieć wspólnego, że liczba atomów, dla każdego z pierwiastków, będzie taka sama przed i po strzałce, gdy równanie chemiczne zostanie zrównoważone.
Utlenianie rtęci
2HG +O2 → Hg2ALBO2
Mamy dwa elementy: rtęć (hg) i tlen (O). Wyrażamy liczbę ich atomów przed (odczynniki), a następnie (produkty) strzałki:
HG: 2 (po lewej) - 2 (po prawej)
Może ci służyć: ułamek molowy: jak jest obliczany, przykłady, ćwiczeniaO: 2 (po lewej) - 2 (po prawej)
Równanie jest zrównoważone, ponieważ atomy HG i lub są takie same po obu stronach strzałki.
Spalanie wodoru
H2 + ALBO2 → H2ALBO
Znowu mamy dwa elementy: wodór (h) i tlen (O). Powtarzanie poprzedniego kroku:
H: 2 - 2
O: 2 - 1
Po lewej stronie jest tlen bardziej niż w prawej stronie. Dlatego musimy dodać kolejny prawy tlen. Aby to zrobić, modyfikujemy współczynniki stechiometryczne, które są liczbami, które towarzyszą i poprzedzają wzory. Jeśli umieścimy 2 przed H2Czy da nam:
H2 + ALBO2 → 2H2ALBO
H: 2 - 4
O: 2 - 2
Tlen jest zrównoważony. Ale nie hydrogeny. Musisz teraz dodać dwa hydrogeny po lewej:
2h2 + ALBO2 → 2H2ALBO
H: 4 - 4
O: 2 - 2
A równanie jest ostatecznie zrównoważone: ta sama liczba H i lub przed i po strzałce.
Zauważ, że współczynniki stechiometryczne (2 dla h2 i 1 dla O2) Pomnóż dolne indeksy formuł. To mnożenie da nam całkowitą liczbę atomów dla określonego elementu.
Redukcja magnezu
Mg (nie3)2 + 2LI → Mg +2lino3
Oceniamy liczby atomów dla każdego elementu:
MG: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Równanie chemiczne jest już zrównoważone i nie ma potrzeby ich równoważenia.
Rozwiązane ćwiczenia
Przed przystąpieniem do zrównoważenia jakiegokolwiek równania, zawsze konieczne jest potwierdzenie, czy nie jest już zrównoważone. To powiedziawszy, kontynuujemy następujące ćwiczenie:
Ćwiczenie 1
Zrównoważone czy nie?
Wiara2ALBO3 + H2O → Faith (OH)3
Mamy trzy elementy: żelazo (wiara), wodór i tlen. Sugestia w momencie równania bilansu jest rozpoczęcie liczenia liczby atomów mniej obfitego elementu w równaniu; który zwykle różni się od H i O. Zatem najpierw liczymy atomy wiary:
Może ci serwować: salicylan metyluWiara: 2 - 1
Kloprze 3 (OH)3 Nie pomnożaj wiary po lewej stronie. Dla H i O mamy:
H: 2 - 3
O: 4 - 3
Wszystkie elementy są niezrównoważone.
Wahadłowy
Przed równowagą H i O, musimy zrównoważyć atomy wiary: najmniej obfity element, ponieważ prawie nie ma 3 wiary, w przeciwieństwie do 5 godzin i 7 lub 7 lub 7. Musisz więc dodać wiarę w prawo:
Wiara: 2 - 2
Co jest równe umieszczenie 2 jako współczynnik stechiometryczny przed wiarą (OH)3. Równanie pozostanie:
Wiara2ALBO3 + H2O → 2fe (OH)3
Wiara: 2 - 2
H: 2 - 6
O: 4 - 6
Ale H i O lub kontynuuj niezrównoważone. H2Lub wnieść 2 godziny i brakuje nam 4 godzin. Dlatego dodamy kolejne dwa H2Lub dla nas, abyśmy mieli trzy h2ALBO:
Wiara2ALBO3 + 3H2O → 2fe (OH)3
I ponownie oceniamy:
Wiara: 2 - 2
H: 6 - 6
O: 6 - 6
Zwróć uwagę, jak je równoważyli, gdy kiedyś zrównoważliśmy H. Równanie jest ostatecznie zrównoważone.
Ćwiczenie 2
Zrównoważone czy nie?
Ch4 + ALBO2 → CO2 + H2ALBO
Oceniamy liczbę atomów dla wszystkich obecnych elementów:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Węgiel jest zrównoważony, ale to samo nie dzieje się w przypadku wodoru i tlenu. Równanie jest niezrównoważone.
Wahadłowy
Ponieważ C jest zrównoważone, nie chcemy modyfikować współczynników stechiometrycznych CH4 lub co2. Przynajmniej w zasadzie.
Koncentrujemy naszą uwagę na H i O, szczególnie na H. Ponieważ? Ponieważ widząc równanie, łatwiej jest zrównoważyć H przed lub. Musimy dodać 2 godziny w prawo, umieszczając współczynnik 2 przed H2ALBO:
Ch4 + ALBO2 → CO2 + 2h2ALBO
C: 1 - 1
H: 4 - 4
O: 2 - 4
C i H są zrównoważone. Zostawiamy 2 lub zostawiamy. Jeśli każdy lub2 wnosi 2 lub dodamy lub2 dodatkowe, aby były 4 lub po lewej stronie. To jest to samo, co umieszczenie współczynnika 2 przed O2:
Może ci służyć: tlenek siarkiCh4 + 22 → CO2 + 2h2ALBO
C: 1 - 1
H: 4 - 4
O: 4 - 4
A równanie jest ostatecznie zrównoważone.
Ćwiczenie 3
Zrównoważone czy nie?
N2 + H2 → NH3
Oceniamy nasze dwa elementy N i H:
N: 2 - 1
H: 2 - 3
Równanie nie jest zrównoważone.
Wahadłowy
Zaczynamy zrównoważyliśmy N, element inny niż H. Brakuje nam prawa i jak każdy NH3 przyczynia się 1 N, musimy dodać kolejny NH3 Mieć 2 n:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
A teraz brakuje nam lewej. Jeśli każde h2 Przyczynić się do równania, a następnie musimy dodać kolejne dwa, aby było 6 godzin. To jest to samo, co umieszczenie współczynnika stechiometrycznego 3 przed H2:
N2 + 3H2 → 2nh3
N: 2 - 2
H: 6 - 6
A równanie chemiczne jest ostatecznie zrównoważone.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Chemia librettexts. (23 listopada 2020). Jak pisać zrównoważone równania chemiczne. Odzyskane z: chem.Librettexts.org
- Wikipedia. (2020). Równanie chemiczne. Źródło: w:.Wikipedia.org
- Zasady chemii. (S.F.). Pisanie i równoważenie równań chemicznych. [PDF]. Źródło: Web.Ung.Edu
- Phet. (S.F.). Równoważenie równań chemicznych. Odzyskany z: phet.Kolorado.Edu
- Armando Marín ur. (S.F.). Chemia ogólna: równoważenie równań. [PDF]. Odzyskane z: depa.Fquim.Unam.MX

