Struktura, właściwości i zastosowania srebrnego bromuro (AGBR)
- 2241
- 670
- Marianna Czarnecki
On Srebrny bromek Jest to sól nieorganiczna, której wzorem chemicznym jest AGBR. Jego stałe składa się z kationów ag+ I Br Aniss- w proporcji 1: 1, przyciągniętych siłami elektrostatycznymi lub linkami jonowymi. Można to zobaczyć, jakby metalowe srebro podało jeden z jego walencji elektronów do bromu molekularnego.
Jego natura przypomina jego chlorek „braci” i srebrne joduro. Trzy sole są nierozpuszczalne w wodzie, mają podobne kolory, a ponadto są wrażliwe na światło; to znaczy cierpią z reakcji fotochemicznych. Ta właściwość została wykorzystana do uzyskiwania zdjęć, w wyniku zmniejszenia jonów Ag+ na metal srebrny.
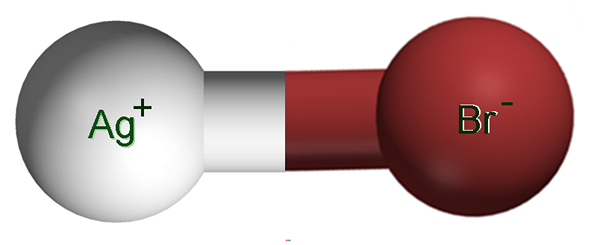
 Srebrne jony bromku. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Srebrne jony bromku. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Na górnym obrazie pokazano parę jonową ag+Br-, w którym białe i brązowe kule odpowiadają jonom Ag+ i br-, odpowiednio. Tutaj reprezentują wiązanie jonowe jako ag-BR, ale należy wskazać, że nie ma takiego kowalencyjnego wiązania między obiema jonami.
Może wydawać się sprzeczne, że srebro to ten, który zapewnia czarny kolor bezbarwnych zdjęć. Wynika to z faktu, że AGBR reaguje z światłem, generując ukryty obraz; który następnie nasila się poprzez zwiększenie redukcji srebra.
[TOC]
Struktura bromku srebrnego
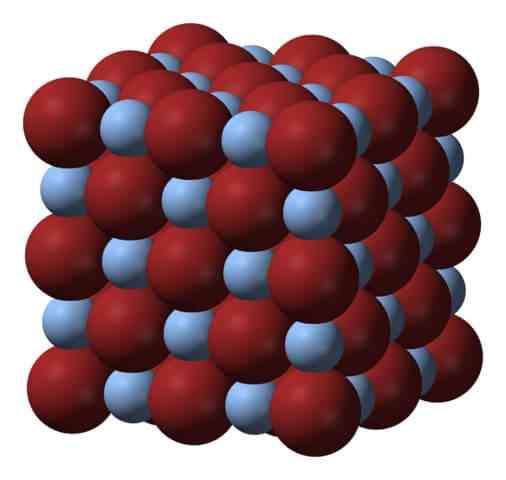 Krystaliczna struktura srebrnego bromku. Źródło: Benjah-BMM27 przez Wikipedia.
Krystaliczna struktura srebrnego bromku. Źródło: Benjah-BMM27 przez Wikipedia. Powyżej sieci lub krystalicznej struktury srebrnego bromku. Tutaj pokazano bardziej wierną reprezentację różnicy wielkości między radiami jonowymi Ag+ i br-. BR aniony-, Bardziej nieporęczne, pozostawiaj szczeliny, w których znajdują się kationy AG+, który jest otoczony sześcioma BR- (i wzajemnie).
Ta struktura jest charakterystyczna dla sześciennego układu krystalicznego, w szczególności typu soli; to samo, na przykład, dla chlorku sodu, NaCl. W rzeczywistości obraz ułatwia to, mając doskonały limit sześcienny.
Może Ci służyć: elektroda odniesienia: charakterystyka, funkcja, przykładyNa pierwszy rzut oka można zauważyć, że istnieje pewna różnica między jonami. To i być może elektroniczne cechy AG+ (i możliwego efektu niektórych zanieczyszczeń) prowadzi do przedstawienia kryształów AgBR; Oznacza to, że miejsca, w których sekwencja zamawiania jonów w przestrzeni to „pęknięcia”.
Wady krystaliczne
Wady te składają się z luk pozostawionych przez nieobecne lub przesunięte jony miejsca. Na przykład wśród sześciu anionów BR- Zwykle powinien być Cruction AG+; Ale zamiast tego może wystąpić próżnia, ponieważ srebro przeniosło się na inny śródmiąższ (wada Frenkel).
Chociaż wpływają one na sieć krystaliczną, faworyzują srebrne reakcje światłem; I im większe kryształy lub ich klaster (wielkość ziarna), tym większa liczba wad, a zatem będzie bardziej wrażliwa na światło. Podobnie zanieczyszczenia wpływają na strukturę i tę właściwość, szczególnie te, które można zmniejszyć za pomocą elektronów.
W wyniku tego ostatniego duże kryształy AGBR wymagają niższej ekspozycji na światło, aby zmniejszyć; to znaczy są bardziej pożądane do celów fotograficznych.
Synteza
W laboratorium można syntetyzować srebrny bromek mieszający wodny roztwór azotanu srebra, Agno3, Z solą bromku sodu, nabab. Pierwsza sól przynosi srebro, a drugi bromek. Poniżej znajduje się podwójna reakcja przemieszczenia lub metateza, którą można reprezentować za pomocą równania chemicznego poniżej:
Agno3(aq) + nabab (s) => nano3(aq) + agbr (s)
Może ci służyć: bromek sodu (NABR)Zauważ, że sól azotanu soli, nano3, Jest rozpuszczalny w wodzie, a AGBR wytrąca się jak stałe o słabym żółtym kolorze. Następnie stałe jest myte i podlega próżni. Oprócz NABB, KBR może być również używane jako źródło anionów bromurowych.
Z drugiej strony, AGBR można uzyskać za pośrednictwem minerałów bromirita i należytej próby oczyszczania.
Nieruchomości
Wygląd
Gliniany stał podobny do gliny.
Masa cząsteczkowa
187,77 g/mol.
Gęstość
6 473 g/ml.
Temperatura topnienia
432 ° C.
Punkt wrzenia
1502 ° C.
Rozpuszczalność wody
0,140 g/ml w 20 ° C.
Współczynnik załamania światła
2253.
Pojemność cieplna
270 J/kg · k.
Wrażliwość na światło
W poprzednim rozdziale powiedziano, że w kryształach AGBR występują wady, które promują wrażliwość tej soli w świetle, ponieważ łapią one utworzone elektrony; I tak teoretycznie zapobiegają im reagowania z innymi gatunkami pośrodku, takimi jak tlen powietrza.
Elektron jest uwalniany z reakcji BR- Z fotonem:
Br- + HV => 1/2br2 + I-
Zauważ, że istnieje2, które farbują stały czerwony, jeśli nie zostanie usunięty. Wyzwolone elektrony zmniejszają kation AG+, W swoich szczeblach, metaliczne srebro (czasami reprezentowane jako AG0):
Ag+ + I- => Ag
Następnie posiadanie równania netto:
AGBR => AG + 1/2BR2
Kiedy powstają „pierwsze warstwy” metalowego srebra na powierzchni, mówi się, że istnieje ukryty obraz, wciąż niewidoczny dla ludzkiego oka. Obraz ten staje się miliony razy bardziej widoczny, jeśli inny gatunek chemiczny (taki jak hydrochinon i fenidon w procesie rozwoju) zwiększa zmniejszenie kryształów AgBR do metalicznego srebra
Może ci służyć: węgiel 12: notacja nuklearna, historia, komentarzeAplikacje
 Czarno -biała kieszonkowa fotografia zegara. Źródło: Pexels.
Czarno -biała kieszonkowa fotografia zegara. Źródło: Pexels. Srebrny bromek jest najczęściej używanym ze wszystkich halogenków w dziedzinie objawienia filmów fotograficznych. AGBR jest stosowany do tych filmów, wykonany z octanu celulozy, zawieszony w galaretce (emulsja fotograficzna) oraz w obecności 4- (metylacji) siarczanu fenolowego (metol) lub fenidonu i hydrochinonu.
Przy wszystkich tych odczynnikach życie można przekazać utajonym obrazie; Zakończ i przyspieszyć transformację jonowego na metalowe srebro. Ale jeśli nie przejdziesz z pewną troską i doświadczeniem, całe srebro powierzchniowe utlenie się, a kontrast między czarnymi i białymi kolorami skończy się.
Dlatego są niezbędne w łazienkach bezrobocia, fiksacji i prania, filmów fotograficznych.
Są artyści, którzy bawią się tymi procesami w taki sposób, że tworzą szare niuanse, które wzbogacają piękno wizerunku i własne dziedzictwo; I wszystko to, czasem, być może bez podejrzewania, dzięki reakcjom chemicznym, których podstawy teoretyczne mogą stać się nieco złożone, a lekki AGBR i to oznacza punkt wyjścia.
Bibliografia
- Wikipedia. (2019). Srebrny bromek. Źródło: w:.Wikipedia.org
- Michael w. Davidson . (13 listopada 2015). Spolaryzowany lekki cyfrowy galeria obrazów: srebrny bromek. Olympus. Odzyskane z: mikro.Magnes.FSU.Edu
- CRYSTRAN LTD. (2012). Srebrny bromek (AGBR). Odzyskany z: cystran.współ.Wielka Brytania
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann i Claudia Schneeweiss. (29 czerwca 2004). Samozwańczy emulsje na bazie srebra dla użytkowników w hologografii: produkcja, przetwarzanie i aplikacja, PROC. SPIE 5290, Hologografia praktyczna XVIII: Materiały i zastosowania; Doi: 10.1117/12.525035; https: // doi.Org/10.1117/12.525035
- Alan G. Kształt. (1993). Chemia nieorganiczna. (Druga edycja.). Redakcja Reverted.
- Carlos Güido i Ma Eugenia Bautista. (2018). Wprowadzenie do chemii fotograficznej. Odzyskane z: fotografii.Ceduc.com.MX
- Garcia d. Piękny. (9 stycznia 2014). Chemia, fotografia i chema Madoz. Odzyskane z: dimetylosulfuro.Jest
- « Jak edukować dziecko odpowiednio 13 praktycznych porad
- Struktura cyklobutanu, właściwości, zastosowania i synteza »

