Struktura cyklobutanu, właściwości, zastosowania i synteza
- 3363
- 274
- Bertrand Zawadzki
On Cyklobutan Jest to węglowodór, który składa się z czterech cyklokano węglowych, którego wzór molekularny wynosi C4H8. Można również nazwać tetrametylen, biorąc pod uwagę, że istnieją cztery jednostki ONZ2 które składają pierścień z geometrią kwadratową, chociaż nazwa cyklobutanu jest bardziej akceptowana i znana.
W temperaturze pokojowej jest to bezbarwny, łatwopalny gaz, który płonie z jasnym płomieniem. Jego najbardziej prymitywne zastosowanie jest źródłem ciepła poprzez spalanie go; Jednak jego podstawa strukturalna (kwadrat) obejmuje głębokie aspekty biologiczne i chemiczne i współpracuje w określony sposób z właściwościami wspomnianych związków.
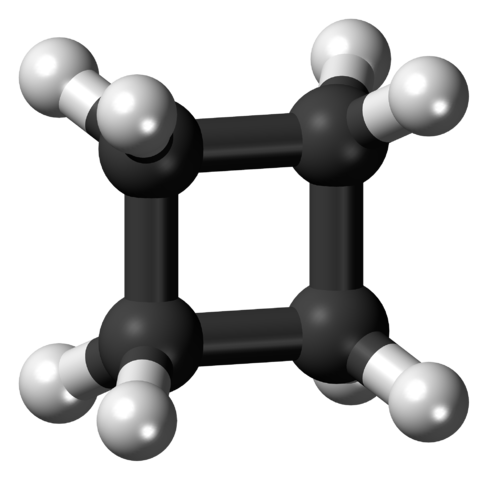 Cząsteczka cyklobutanu w napiętej konformacji. Źródło: Jynto [CC0].
Cząsteczka cyklobutanu w napiętej konformacji. Źródło: Jynto [CC0]. Na górnym obrazie pokazano cząsteczkę cyklobutanu o kwadratowej strukturze. W następnej sekcji zostanie wyjaśnione, dlaczego ta konformacja jest niestabilna, ponieważ jej linki są napięte.
Po cyklopropo jest to najbardziej niestabilny cykloalcan, ponieważ im mniejszy rozmiar pierścienia, tym bardziej reaktywny będzie. Zgodnie z tym cyklobutan jest bardziej niestabilny niż cykle pentanu i heksano. Ciekawe jest jednak w swoich pochodnych rdzeń lub kwadratowe serce, które, jak będzie widać, jest dynamiczne.
[TOC]
Struktura cyklobutanu
Na pierwszym obrazie struktura cyklobutanu została rozwiązana jako prosty węgiel i uwodorniony kwadrat. Jednak na tym doskonałym placu orbitale cierpi na poważne przeskoczenie ich pierwotnych kątów: są one oddzielone kątem 90º3 (napięcie kątowe).
Sploty węgla samochodowego3 Są tetrahedralami, a dla niektórych tetrahedrów trudno byłoby zgiąć oba orbitale, aby utworzyć kąt 90º; Ale byłoby to jeszcze więcej w przypadku węgli z hybrydyzacją SP2 (120º) i SP (180º) odwracają oryginalne kąty. Z tego powodu cyklobutan ma atomy węgla SP3 w istocie.
Może ci służyć: alkohol wtórny: co to jest, struktura, właściwości, użyciaRównież atomy wodoru są bardzo blisko siebie, przyćmione w przestrzeni. Powoduje to wzrost przeszkód sterycznych, który osłabia domniemany kwadrat pod kątem wysokiego napięcia skrętnego.
Dlatego napięcia kątowe i skrętne (zamknięte w terminu „napięcie pierścieniowe”) sprawiają, że ta konformacja jest niestabilna w normalnych warunkach.
Cyklobutan.
Motyle lub pomarszczone konformacje
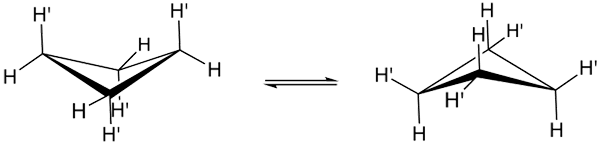 Konformacje cyklobutanu. Źródło: Smokefoot.
Konformacje cyklobutanu. Źródło: Smokefoot. Prawdziwe konformacje cyklobutano pokazano powyżej. W nich spadają napięcia kątowe i skrętne; Ponieważ, jak widać, nie wszystkie atomy wodoru są zaćmione. Istnieje jednak koszt energii: kąt jego linków jest zaostrzony, to znaczy niski od 90 do 88º.
Należy zauważyć, że można to porównać do motyla, którego trójkątne skrzydła są tworzone przez trzy atomy węgla; i czwarty, ustawiony pod kątem 25º w odniesieniu do każdego skrzydła. Podwójne strzałki w sensie wskazują, że istnieje równowaga między obiema konformatorami. To tak, jakby motyl w dół i wspinał się na skrzydła.
Z drugiej strony u osób pochodzących z cyklobutanu, można by oczekiwać, że ten trzepot będzie znacznie wolniejszy i zapobiegał przestrzennie.
Interakcje międzycząsteczkowe
Załóżmy, że zapominasz przez kilka chwil kwadratów i zastąp je na miejscu karączymi motylami. Jesteś w ich trzepotliwym, możesz być trzymany razem w cieczy za pomocą londyńskich sił dyspersji, które są proporcjonalne do obszaru ich skrzydeł i masy cząsteczkowej.
Może ci służyć: grupa karbonylowa: charakterystyka, właściwości, nomenklatura, reaktywnośćNieruchomości
Wygląd fizyczny
Bezbarwny gaz.
Masa cząsteczkowa
56 107 g/mol.
Punkt wrzenia
12,6ºC. Dlatego w chłodnych warunkach można go zasadniczo manipulować jak każdy płyn; Z jedynym szczegółem, że byłoby to bardzo niestabilne, a ich opary nadal stanowiłyby ryzyko wzięcia pod uwagę.
Temperatura topnienia
-91ºC.
punkt zapłonu
50ºC zamknięta kubek.
Rozpuszczalność
Nierozpuszczalny w wodzie, co nie jest zaskoczone, biorąc pod uwagę jej nie apolowy charakter; Ale jest nieco rozpuszczalny w alkohole, eterze i acetonie, które są mniej polarnymi rozpuszczalnikami. Oczekuje się, że będzie rozpuszczalny (choć nie zgłoszony) logicznie w rozpuszczalnikach apolarnych, takich jak tetrachlorowodorek węgla, benzen, ksylen itp.
Gęstość
0,7125 do 5ºC (w stosunku do 1 z wody).
Gęstość pary
1,93 (w stosunku do 1 powietrza). Oznacza to, że jest gęsty niż powietrze, a zatem, chyba że istnieją prądy, jego trend nie będzie rosł.
Ciśnienie pary
1.180 mmHg w 25ºC.
Współczynnik załamania światła
1 3625 do 290ºC.
Entalpia spalania
-655,9 kJ/mol.
Ciepło formacyjne
6,6 kcal/mol a 25ºC.
Synteza
Cyklobutan jest syntetyzowany przez uwodornienie cyklobutadienu, którego struktura jest prawie taka sama, z jedyną różnicą, że ma podwójne wiązanie; I dlatego jest jeszcze bardziej reaktywny. Jest to być może najprostsza syntetyczna droga do jej uzyskania, a przynajmniej tylko dla niego, a nie do pochodnej.
W ropie jest mało prawdopodobne, ponieważ ostatecznie zareagowałby w taki sposób, że złamał pierścień i uformował się łańcuch linii, to znaczy n-butane.
Inną metodą uzyskania cyklobutanu jest wpływanie na promieniowanie ultrafioletowe na cząsteczki etylenu, CH2= Ch2, które są mierzone. Ta reakcja jest uprzywilejowana fotochemicznie, ale nie termodynamicznie:
Może ci służyć: Benchilo Benzoate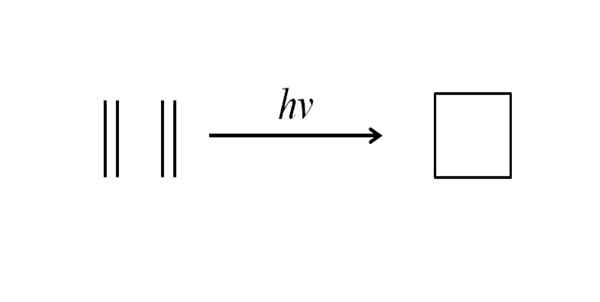 Synteza cyklobutanu przez promieniowanie ultrafioletowe. Źródło: Gabriel Bolívar.
Synteza cyklobutanu przez promieniowanie ultrafioletowe. Źródło: Gabriel Bolívar. Górny obraz podsumowuje to, co zostało powiedziane w powyższym akapicie. Gdyby zamiast etylenu było to na przykład dowolne dwa alkeny, uzyskano zostałby wymieniony cyklobutan; lub co to samo, pochodna cyklobutanu. W rzeczywistości wiele pochodnych o interesujących strukturach zostało zsyntetyzowanych za pomocą tej metody.
Inne pochodne oznaczają jednak serię skomplikowanych syntetycznych kroków. Dlatego Cyclobuta (jak nazywa się ich pochodne), podlega badaniu syntezy organicznej.
Aplikacje
Sam cyklobutan nie ma więcej użycia niż do służenia jako źródło ciepła; Ale jego pochodne wchodzą w misterne grunty w syntezie organicznej, z zastosowaniem farmakologii, biotechnologii i medycyny. Bez pogłębiania zbyt złożonych struktur, PenTrems i Grandisol są przykładami cyklobutanów.
Cyklobutany mają na ogół właściwości korzystne dla metabolizmu bakterii, roślin, bezkręgowców morskich i grzybów. Są biologicznie aktywne i dlatego ich zastosowania są bardzo zróżnicowane i trudne do określania, ponieważ każdy ma swój szczególny wpływ na niektóre organizmy.
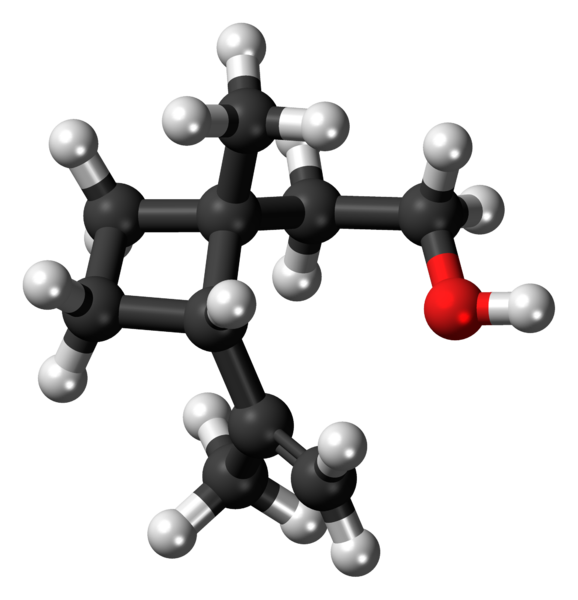
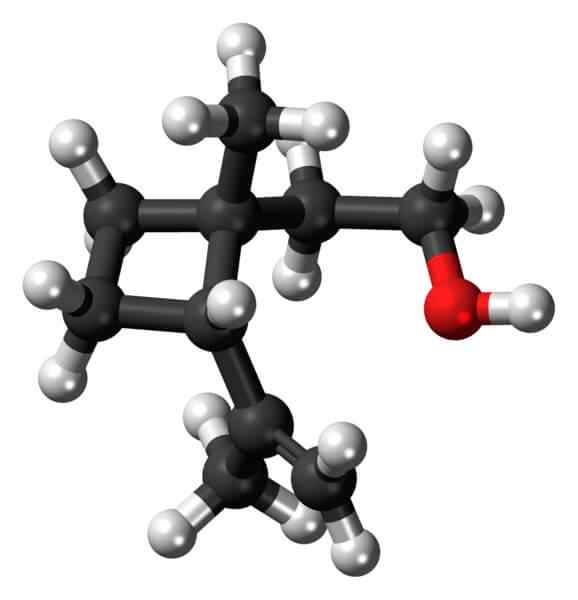 Grandisol: przykład pochodnej cyklobutanu. Źródło: Jynto [CC0].
Grandisol: przykład pochodnej cyklobutanu. Źródło: Jynto [CC0]. Na przykład Grandisol to feromon Gorgjo (rodzaj chrząszcza). Powyżej, a wreszcie jego struktura jest wyświetlana, uważana za monoterpenę z kwadratową podstawą cyklobutanu.
Bibliografia
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons, t.W.; Craig b. Fryhle. (2011). Chemia organiczna. (jedenaścieth wydanie). Wiley.
- Wikipedia. (2019). Cyklobutan. Źródło: w:.Wikipedia.org
- Pubchem. (2019). Cyklobutan. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Peiris Nicole. (29 listopada 2015). Fizyczne właściwości cykloalkanów. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wiberg b. Kenneth. (2005). Właściwości cyklobutanu-fizyczne i badania teoretyczne. Wydział Chemii, Uniwersytet Yale.
- Klement Foo. (S.F.). Cyklobutany w syntezie organicznej. Źródło: Scripps.Edu
- Myers. (S.F.). Synteza cyklobutanów. Chem 115. Odzyskane z: hwpi.Harvard.Edu
- « Struktura, właściwości i zastosowania srebrnego bromuro (AGBR)
- Charakterystyka, typy i skutki leków syntetycznych »

