Historia, struktura, właściwości, zastosowania, synteza, ryzyko

- 3659
- 92
- Marianna Czarnecki
On Boraks lub boran sodu Jest to wyznanie dla grupy związków chemicznych o podstawowym wzorze Na2B4ALBO7. Jest to sól higroskopijna zdolna do tworzenia licznych hydratów, oprócz strukturalnego wzbogacania się przez obecność niektórych zanieczyszczeń metali.
Główne związki nazywane boraksem są następujące: anhydro tetraborate, na2B4ALBO7; Pentahydrate tetaboratu sodu (na2B4ALBO7).5h2ALBO; i tetraborate sodu, na2B4ALBO7.10h2Lub lub jego równoważny, oktahydrate tetraborate2B4ALBO5(OH)4.8h2ALBO.
 Fragment boraksa. Źródło: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Fragment boraksa. Źródło: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Jak widać, wszystkie poprzednie stałe różnią się tylko stopniem nawodnienia; Niektóre mają więcej cząsteczek wody w swoich kryształach niż inne. Fizycznie boraks jest podobny do kawałków lub solidnych kryształów kredowych (obraz doskonały).
Oczywiście boraks znajduje się w osadach sezonowych jezior, suszony przez parowanie. Boraks występuje w Turcji, Searles Lakes (Kalifornia), w Atacama, Chile, Boliwia, Tybecie i Rumunii. Syntetycznie kryształy boraksu można uzyskać poprzez powolny proces zarodkowania; to znaczy, w którym faworyzowany jest wzrost kryształów.
Sodu, bezwodne i rozkładane tetraborate, są nieco rozpuszczalne w zimnej wodzie; ale jego rozpuszczalność wzrasta wraz ze wzrostem temperatury. Następnie2B4ALBO7.10h2Lub jest bardzo rozpuszczalny w glikolu etylenowym, umiarkowanie rozpuszczalnym w etanolu i niewiele rozpuszczalnym w acetonie; Są to mniej polarne rozpuszczalniki niż woda.
Borax ma wiele zastosowań, takich jak opracowanie detergentów i mydeł; jako opóźnienie pożaru materiału celulozowego; w produkcji włókna szklanego; w czyszczeniu twardych powierzchni, takich jak metale, szkło i ceramika; oraz w hamowaniu korozji, między innymi.
Boraks jest drażniący dla oczu, skóry i dróg oddechowych. Przez spożycie może wytwarzać między innymi objawy, wymioty, biegunkę, zwiotczenie, rozkład i napady. Obecnie podejrzewa się, że może mieć szkodliwy wpływ na reprodukcję człowieka.
[TOC]
Historia
Historia boraksu jest myląca. Wskazuje się, że odkryto go w łóżku jeziora Tybetu, wysuszone przez parowanie. Został przeniesiony w siódmym wieku Tybetu do Arabii Saudyjskiej, podążając SO -Called Silk Route.
Termin „boraks” był popularny po licznych aplikacjach, które zostały znalezione i sprzedawane pod nazwą 20 Mule Team Boraks Tradermax, które odnosiły się do sposobu, w jaki boraks był transportowany przez pustynie Nevady i Kalifornii.
Inna wersja ich odkrycia wskazuje, że Egipcjanie wiedzieli ze swojego istnienia od dłuższego czasu, używając go w spoinach metali przez ciepło. Ponadto wykorzystali go w medycynie i w procesie mumifikacji. Borax został przeniesiony do Europy w XIII wieku przez Marco Polo.
W połowie inineenth wieku na pustyni Magove odkryto duże złoża boraksa.
Struktura boraksu
 Struktura jonowa boraksu. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Struktura jonowa boraksu. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Najwyższy obraz pokazuje jony tworzące boraks, szczególnie odpowiadające ciałowi stałym o formule składu2[B4ALBO5(OH)4] · 8H2Lub (lub na2B4ALBO7· 10H2ALBO).
Po pierwsze, można zauważyć strukturę w klatce anionu [B4ALBO5(OH)4]2- (Chociaż powinienem mieć dwie grupy-), w którym widać ośmiokątny pierścień (cztery atomy B i cztery O)), z mostem B-O-B, dzieląc go na dwie połówki.
Może ci służyć: Rozwiązania alkaliczne: definicja, właściwości i zastosowaniaKlatka ta nie pozostaje statyczna, ale wibruje i przyjmuje różne konformacje w przestrzeni; Jednak w mniejszym stopniu w pobliżu mostu. Można również zauważyć, że jest bardzo „utleniony”; Oznacza to, że ma wiele atomów tlenu, zdolnych do interakcji z cząsteczkami wody za pomocą mostów wodorowych.
Nic więc dziwnego, że kryształy boraksu mogą nawodnić i generować wiele hydratów. Zatem dla solidnego na2[B4ALBO5(OH)4] · 8H2Lub jest osiem cząsteczek H2Lub interakcje z klatką boraranu, a jednocześnie z metalowymi centrami Na+.
Po stronie kationów masz wodny kompleks [na (h (h (h (h (h2ALBO)4]+N, gdzie wartość n będzie zależeć od proporcji anionów/kationów. W górnej części stałej n = 2, więc masz: [na2(H2ALBO)8]2+, którego obciążenie 2+ neutralizuje obciążenie 2- anionu boraranu.
Kryształy
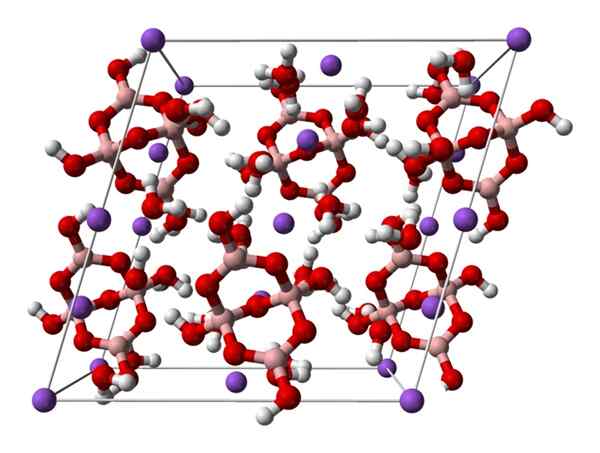 Komórka monokliniczna boraksu. Źródło: Ben Mills [publiczne
Komórka monokliniczna boraksu. Źródło: Ben Mills [publiczneDomena].
W górę2[B4ALBO5(OH)4] · 8H2Lub na2B4ALBO7· 10H2ALBO. Tutaj atrakcje elektrostatyczne i mosty wodorowe rządzą lub dominują w wzorach konstrukcyjnych powstających w każdej szklance szklanki.
Inne hydraty i bezwodna sól tracą jedną lub wszystkie cząsteczki wody, zmieniając skład i strukturę kryształu boraksu. We wszystkich z nich anion i kation pozostają takie same (chyba że są zanieczyszczenia lub reakcje boczne), więc nie można wygenerować zamieszania.
Zamieszanie z anionem Boraato
Na2[B4ALBO5(OH)4] · 8H2Lub na2B4ALBO7· 10H2Lub są takie same. Ponieważ?
Po pierwsze, jeśli ich atomy zostaną policzone, zobaczą, że pokrywają się w liczbie; A po drugie, w anionie B4ALBO72- Brak dwóch grup OH powiązanych z głowami boru mostów B-O-B; dwa och, wraz z dwoma H+ z b4ALBO72-, Dodaj do 2 godzin2Lub dając łącznie 10 godzin2O (8 + 2).
Nieruchomości
Nazwy
- Boraks.
- Boraran sodu.
- Tetaborate sodu.
- Dacjonalny tetraborate.
Masa cząsteczkowa
Anhydro: 201,22 g/mol.
Dekohydrat: 381,38 g/mol.
Wygląd fizyczny
Krystaliczna biała stała.
Gęstość
Bezwodne: 2,4 g/cm3
Decyahikstura: 1739 g/cm3
Temperatura topnienia
Anhidro: 743 ºC (1.369 ° F, 1.016 K).
Dekohydrat: 75 ° C.
Punkt wrzenia
Anhidro: 1.575 ° C (2.867 ºF, 1.848 K).
Rozpuszczalność wody
31,78 g/l (oba dla bezwodnego i rozkładu).
Rozpuszczalność w rozpuszczalnikach organicznych
Jest bardzo rozpuszczalny w glikolu etylenowym, umiarkowanie rozpuszczalnym w glikolu dietylenowym i metanolu i lekko rozpuszczalnym w acetonie.
Wskaźnik refrakcji (ηd)
Anhidro: η1 = 1 447; η2 = 1 469.
Suppedrado: η2 = 1 472.
Stabilność
Jest stabilny w odpowiednich warunkach przechowywania. Chociaż ma niskie ciśnienie pary, wzrasta wraz z temperaturą, powodując krystalizację i kondensację, dlatego należy unikać nadmiernej temperatury i wilgoci.
Emisja światła
Tetraborowanie sodu, gdy poddane działaniu ognia emituje zielone światło.
Reakcje
- Podczas rozpuszczania się w wodzie roztwory alkaliczne pochodzą z pH około 9,2.
- Borax reaguje, tworząc inne boraty, takie jak perborate (PBS).
- Wytwarza również kwas borowy podczas reagowania z kwasem solnym:
Na2B4ALBO7· 10H2O + hcl => 4 h3Bo3 + 2 na+ + 2 Cl- + 5 godzin2ALBO
- Tetaboralne sodu zachowuje się jak substancja amfohete, ponieważ w roztworze wodnym jest hydrolizowana i jest w stanie zneutralizować kwas. W ten sam sposób jest w stanie zneutralizować alkalis wysokiego stężenia, unikając nadmiernego podwyższenia średniego pH.
Może ci służyć: alkohol podstawowy: struktura, właściwości, nomenklatura, przykładyAplikacje
Borax ma wiele zastosowań, zarówno w ludzkiej istocie, jak i w zbiorze działań, które wykonuje.
Działanie przeciwutleniające
Borax ma zdolność rozpuszczania tlenków. Z tego powodu jest używany do odzyskiwania metali, takich jak mosiądz, miedź, ołów i cynk.
Służy również do zapobiegania utlenianiu metalowych prętów w fundamentach. Borax obejmuje jego powierzchnię, z wyłączeniem powietrza, a zatem unikając utleniania. Ponadto zapobiega korozji materiału żelaznego w produkcji samochodów.
Rozpuszczalność boraksu w glikolu etylenowym była przydatna w preparatach przeciwdziałania. Boraks zneutralizuje kwaśne odpady wytwarzane podczas rozkładu glikolu etylenowego, minimalizując utlenianie, którą może cierpieć powierzchnia metali.
Opracowanie klejów
- Borax jest częścią sformułowania kleju skrobiowego do papierowego papieru i kartonu.
- Jest to środek peptyczny w produkcji klejów opartych na kazeinie i dekstrynie.
- Działa wzmacniające materiały klejowe poprzez przekroczenie sprzężonych grup wodoroksylowych.
Ognioodporny
Jest stosowany jako opóźniony w materiałach ogniowych w materiałach celulozowych i innych polimerach zawierających grupy wodorotlenowe. Wywiera swoje działanie poprzez kilka mechanizmów, w tym tworzenie szklistej warstwy, która ogranicza dostęp do paliw.
Borosilizowane szklane opracowanie (Pyrex)
Borax jest źródłem boru stosowanego w opracowaniu szklanki borosilizowanej; charakteryzujący się wysokim punktem fuzji, niskim współczynnikiem rozszerzalności i wysoką odpornością na wstrząsy termiczne.
Pozwala to podlegać wysokim temperaturom bez doświadczania złamań, otrzymywania denominacji szkła opornej.
Szkło borosilizowane jest używane do opracowania materiałów do użytku w domu do pieczenia żywności. Jest również stosowany w laboratorium w Beaker, Fixolas, mierzy cylindry, pipety itp.
Emulgator
Borax, wraz z innymi związkami, służy do emulsyjności mydeł i innych parafin. Jest również wykorzystywany jako podstawa do opracowania balsamów, kremów i maści.
Material czyszczacy
- Dodaje się w preparatach do czyszczenia twardych powierzchni, takich jak metale, szkło i ceramika.
- Jest używany w środkach do czyszczenia ręki, materiałach polerowania i mydłach do użytku w pralni i domu. Ponadto ułatwia usunięcie oleistych złóż z podłóg fabryk.
Zastosowania medyczne
- Jest stosowany w leczeniu infekcji grzybów stóp.
- Jest częścią formuły składników odżywczych, która dostarcza bor. Uważa się, że ten pierwiastek interweniował w metabolizmie wapnia, fosforu i magnezu, jest niezbędny do struktury kości.
- Interweniuje w określeniu glikozylowanej hemoglobiny (HBA1C), dowód, który służy do poznania rozwoju długoterminowej cukrzycy u pacjenta, ponieważ czas półtrwania wynosi 120 dni.
Informacje te są bardziej przydatne dla lekarza niż izolowane oznaczenia glukozy we krwi pacjenta.
PH Absorbber
Jest stosowany w kilku amortywach pH stosowanych w biochemii; Wśród nich Tris (hydroksymetylo) aminometan-bora, stosowany w elektroforezy w poliakryloamidu DNA i kwasów nukleinowych RNA.
Zmniejszyć twardość wody
Borax jest w stanie połączyć się z jonami wapnia i magnezu obecnymi w wodzie, zmniejszając jego stężenie. W ten sposób twardość wody jest zmniejszona.
Może ci służyć: wodorotlenek potasu: struktura, właściwości, zastosowaniaNawóz i nawóz
Borax jest używany jako źródło boru. Wapń i bor są zaangażowane w tworzenie ściany komórkowej rośliny. Ponadto wskazano, że bor sprzyja zapylaniu, więc interweniuje on w zapłodnienia i proliferacji roślin.
Drewniana ochrona
Borax walczy z Woodwoodem, chrząszczem, który zużywa i niszczy drewno. Jest również stosowany w ochronie i konserwacji drewnianych statków.
Założenie i przepływ
Jest stosowany jako założyciel spawania stali i żelaza, powodując zmniejszenie temperatury topnienia i eliminację tlenku żelaza; Niepożądany zanieczyszczenie. Z podobnym końcem uczestniczy w spawaniu złota i srebra.
Inni
- Jest stosowany jako miękki pestycyd; Na przykład w walce z ćmami w wełnie.
- Spryskane serwowane do kontroli szkodników obecnych w szafkach, złóż wewnętrznych, w szczelinach ścian i ogólnie, gdzie użycie bardziej zanieczyszczających pestycydów nie jest pożądane.
- Jest stosowany w reaktorach jądrowych do kontrolowania reakcji, które w skrajnych przypadkach mogłyby wytwarzać reakcję łańcuchową.
- W grzejnikach samochodów Borax służy do uzyskania miejsc, w których występują ucieczki wody.
Synteza
Borax jest uzyskiwana przez React5ALBO9.8h2Lub, z węglanem sodu i węglowodorem sodu w podłożu wodnym.
W rzeczywistości niewiele stosuje się synteza tetraboratu sodu lub boraksu; Większość wytworzonego związku jest uzyskiwana przez jego ekstrakcję zawierających minerałów.
Proces ten można podsumować w roztworze rudy w wodzie, a następnie filtracji gliny i wreszcie parowanie roztworu wodnego.
Ryzyko
Borax jest naturalnym produktem, jednak może wywoływać szereg szkód zdrowotnych u ludzi. Na przykład z powodu kontaktu z pyłem pyłu może wystąpić podrażnienie skóry, które może spowodować zapalenie skóry.
Podobnie, boraks powoduje podrażnienie oczu i górnych dróg oddechowych. Wśród objawów jego wdychania występują ból kaszlu i gardła.
Tymczasem spożycie boraksu przedstawia następujące objawy: wymioty, nudności, biegunka, zwiotczenie, ból głowy i napady. Ponadto może wystąpić wpływ ośrodkowego układu nerwowego i funkcjonowania nerek.
Z badań przeprowadzonych u mężczyzn -płciowych szczurów, karmionych borakiem, zaobserwowano zanik jąder. Podczas gdy badania przeprowadzone z ciężarnymi szczurami wskazywały, że Boraks może przekroczyć łożysko, powodując zmianę rozwoju płodu, objawiając się niską masą urodzeniową.
Uważa się, że ekspozycja na boraks może wpływać na męską funkcję reprodukcyjną u człowieka, objawiając się zmniejszeniem liczenia nasienia.
Szacuje się śmiertelną dawkę od 10 do 25 gramów dla spożycia boraksu u dorosłych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- National Center for Biotechnology Information. (2019). Argon. Baza danych Pubchem. CID = 23968. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Karolyn Burns, Seneca Joseph i Dr. Ryan Baumbach. (S.F.). Synteza i właściwości kryształów boraksu i stopów międzymetallicznych. Odzyskany z: NationalMaglab.org
- Wikipedia. (2019). Boraks. Źródło: w:.Wikipedia.org
- Rio Tinto. (2019). Odgłos boraksu. 20 Mule Team Borax. Odzyskany z: boraks.com
- Fletcher Jenna. (14 stycznia 2019). Czy Borax jest bezpieczny w użyciu? Odzyskany z: MedicalNewstody.com
- « Struktura chlorku chromu (CRCL3), właściwości, zastosowania
- Transgeniczne cechy żywności, zalety, przykłady, konsekwencje »

