Struktura chlorku chromu (CRCL3), właściwości, zastosowania

- 2735
- 18
- Matylda Duda
On Chlorek chromowy (CRCL3) Jest to sól nieorganiczna złożona z kationów CR3+ i aniony CL- w proporcji 1: 3; to znaczy dla każdego CR3+ Są trzy CL-. Jak widać później, ich interakcje nie są jonowe. Ta sól może wystąpić w dwóch postaciach: anhydra i hexahydrat.
Bezhodny kształt charakteryzuje się przedstawieniem fioletowo-czerwonawego zabarwienia; Podczas sześciokadru, CRCL3.6h2Lub jest ciemnozielona. Włączenie cząsteczek wody modyfikuje właściwości fizyczne tych kryształów; Jako punkty gotowania i fuzji, gęstości itp.
 Fioletowe kryształy chlorku chlorku (III). Źródło: Ben Mills [domena publiczna]
Fioletowe kryształy chlorku chlorku (III). Źródło: Ben Mills [domena publiczna] Chlorek chromowy (III) (zgodnie z nomenklaturą zapasową) rozkłada się w wysokich temperaturach, stając się chlorkiem chromu (II), CRCL2. Jest żrący dla metali, chociaż jest stosowany w chromie: procedura, w której metale są pokryte cienką chromową warstwą.
Cr3+, Pochodzący z odpowiedniego chlorku, został zastosowany w leczeniu cukrzycy, szczególnie u pacjentów z całkowitym żywieniem pozajelitowym (TPN), które nie spożywają wymaganej ilości chromu. Jednak wyniki są znacznie lepsze (i bardziej niezawodne), jeśli są dostarczane jako pikolinato.
[TOC]
Struktura chlorku chromu
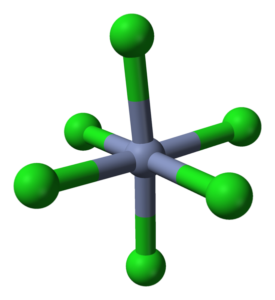 Koordynacja oktaedro dla CRCL3 w swoich kryształach. Źródło: Ben Mills [domena publiczna]
Koordynacja oktaedro dla CRCL3 w swoich kryształach. Źródło: Ben Mills [domena publiczna] CRCL3 Pomimo tego, że jest solą, natura ich interakcji nie jest czysto jonowa; Mają pewien kowalencyjny charakter, produkt koordynacji między Cr3+ i Cl-, które powodują zdeformowany oktahedron (obraz doskonały). Chrom znajduje się w środku Octaedro, a chloros na wierzchołkach.
Octahedron CRCL6 Na pierwszy rzut oka możesz zaprzeczać formule CRCL3; Jednak ten kompletny oktacz nie definiuje komórki elementarnej szkła, ale sześcian (również zdeformowany), który przecina zielone kule lub aniony chloru na pół.
Może ci służyć: 20 przykładów sublimacji chemicznej i cechKrystaliczne warstwy bezwodne
Zatem jednolita komórka z tym okaedro nadal utrzymuje proporcję 1: 3. Odtwarzając te zdeformowane kostki w przestrzeni, otrzymuje się kryształ CRCL3, który jest reprezentowany na obrazie wyższym z trójwymiarowym modelem wypełniania oraz modelem sfer i prętów.
 Warstwa struktury krystalicznej CRCL3 reprezentowanej z trójwymiarowym modelem i prętami. Źródło: Ben Mills [domena publiczna]
Warstwa struktury krystalicznej CRCL3 reprezentowanej z trójwymiarowym modelem i prętami. Źródło: Ben Mills [domena publiczna] Ta krystaliczna warstwa jest jedną z wielu, które tworzą3 (Nie myl koloru szkła, prawda, z kolorem zielonych kul).
Jak widać, aniony CL- Zajmują powierzchnię, więc ich ujemne obciążenia odpychają inne krystaliczne warstwy. W związku z tym kryształy stają się oszustw i kruche; Ale genialne, z powodu chromu.
Jeśli te same warstwy zostaną wizualizowane z perspektywy bocznej, będą one obserwowane, zamiast oktahedry, zniekształconych czworości:
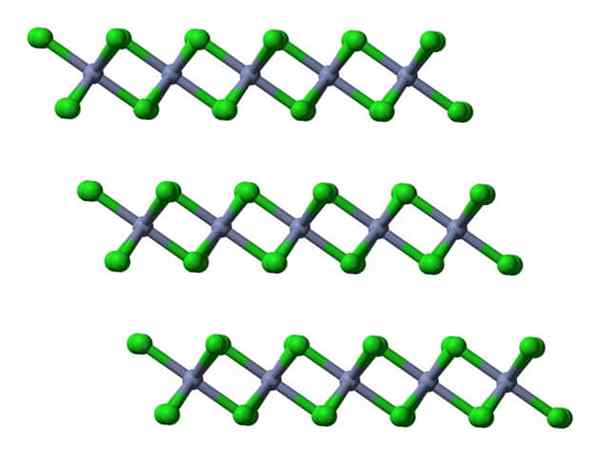 CRCL3 krystaliczne warstwy widoki bocznie. Źródło: Ben Mills.
CRCL3 krystaliczne warstwy widoki bocznie. Źródło: Ben Mills. Tutaj zrozumienie, dlaczego warstwy są ze sobą odpychane- jego powierzchni.
Nieruchomości
Nazwy
-Chlorek chromowy (III)
-Chromowy trichlorek (III)
-Chlorek chlorek (iii) bezwodny.
Wzór chemiczny
-Crcl3 (bezwodny).
-Crcl3.6h2O (sześciokąt).
Waga molekularna
-158,36 g/mol (bezwodny).
-266,43 g/mol (heksahydrat).
Opis fizyczny
-Kryształy stałe i fioletowo-szczelne (bezwodne).
-Dark zielony krystaliczny pył (sześciokadrat, niższy obraz). W tym hydracie można go postrzegać, gdy woda hamuje jasność, cecha metalu chromu.
 Chrome sześciobratu chromu. Źródło: Użytkownik: Walkerma [domena publiczna]
Chrome sześciobratu chromu. Źródło: Użytkownik: Walkerma [domena publiczna] Temperatura topnienia
-1.152 ° C (2.106 ° F, 1.425 K) (anhydrum)
-83 °.
Punkt wrzenia
1300 ° C (2.370 ° F, 1.570) (anhydrum).
Rozpuszczalność wody
 Wodne roztwory chlorku chromu (III). Źródło: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Wodne roztwory chlorku chromu (III). Źródło: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] -Lekko rozpuszczalne (anhydro).
-585 g/l (heksahydrat).
Na górnym obrazie pokazano serię rur testowych wypełnionych wodnym roztworem CRCL3. Zauważ, że im bardziej skoncentrowany, tym intensywny kolor kompleksu [Cr (OH2)6]3+, Odpowiedzialny zielony kolor.
Może ci służyć: putrescina: struktura, właściwości, synteza, użyciaRozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalne w etanolu, ale nierozpuszczalne w eterze (bezwodne).
Gęstość
-2,87 gr/cm3 (bezwodny).
-2,76 g/cm3 (Hexahydrate).
Temperatura przechowywania
Rozkład
Po podgrzaniu do rozkładu chlorek chromu (III) emituje toksyczne opary związków zawierających chlor. Związki te są również uwalniane, gdy chlorek chromowy (III) kontaktuje się z silnymi kwasami.
Korozja
Jest wysoce żrący i może atakować niektóre stali.
Reakcje
Jest niezgodny z silnymi utleniaczami. Reaguje również silnie z litem i azotem.
Gdy jest ogrzewany w obecności wodoru, jest on redukowany do chlorku chromu (II), wraz z tworzeniem się chlorku wodoru.
2 Crcl3 + H2 => 2 crcl2 + 2 HCl
Ph
W roztworze wodnym i o stężeniu 0,2 m: 2,4.
Synteza
Produkowany jest chlorek chlorku chromu (III), reagując wodorotlenek chromu z kwasem chlorowodorowym i wodą.
CR (OH)3 + 3 HCl +3 H2O => crcl3.6h2ALBO
Następnie, aby uzyskać sól anodry, CRCL jest podgrzewana3.6h2Lub w obecności chlorku tionilo, SOCL2, kwas chlorowy i ciepło:
[Cr (h2ALBO)6] Cl3 + 6socl2 + ∆ → Crcl3 + 12 HCl + 6SO2
Alternatywnie, CRCL3 Gaz chloru uzyskuje się na mieszaninie chromu i tlenku węgla.
Cr2ALBO3 + 3 C +Cl2 => 2 crcl3 + 3 co
I wreszcie, będąc najczęściej stosowaną metodą, jest ogrzewanie tlenku za pomocą środka halogenowego, takiego jak tetrachlor węglowy:
Cr2ALBO3 + 3ccl4 + ∆ → 2crcl3 + 3cocl2
Aplikacje
Przemysłowcy
Chlorek chlorek interweniuje w przygotowaniu ON -SITE chlorku chromu (II); odczynnik, który interweniuje w zmniejszeniu halogenków alkilowych i syntezy halluros (E) -salquenilo.
Może ci służyć: szczawian sodu (Na2C2O4): struktura, właściwości, zastosowania, ryzyko-Jest stosowany w technice chromowanej. Polega to na osadzaniu się przez galwanoplastykę, cienką warstwę chromu na metalowych obiektach lub innym materiale z celem dekoracyjnym, zwiększając w ten sposób odporność na korozję, a także twardość powierzchni.
-Jest używany jako mordant tekstylny, który służy jako związek między materiałami barwienia a tkaninami do barwiania. Ponadto jest stosowany jako katalizator produkcji olefin i środków wodoodpornych.
Lecznictwo
Zaleca się zastosowanie suplementu chlorku U USP u pacjentów, którzy otrzymują roztwory dożylne, podawane do całkowitego żywienia pozajelitowego (TPN). Dlatego tylko wtedy, gdy ci pacjenci nie otrzymują wszystkich swoich wymagań żywieniowych.
Chrom (III) jest częścią czynnika tolerancji glukozy, aktywatora reakcji promowanych przez insulinę. Uważa się, że chrom (III) aktywuje metabolizm glukozy, białek i lipidów, ułatwiając działanie insuliny u ludzi i zwierząt.
Chrom jest obecny w licznych produktach spożywczych. Ale jego stężenie nie przekracza 2 przez racjonowanie, a brokuły to jedzenie z największym wkładem (11 µg). Ponadto wchłanianie jelit chromu jest niskie, o wartości 0,4 do 2,5% spożywanej ilości.
To utrudnia ustanowienie diety dla Chrome Supply. W 1989 r.
Ryzyko
Wśród możliwych ryzyka spożycia tej soli jako suplementu chromowego są:
-Silne bóle żołądka.
-Nieprawidłowe krwawienie, które mogą różnić się od trudności w wyleczeniu rany, czerwonych siniaków, lub ciemnienia kału produktu stołka wewnętrznego krwawienia wewnętrznego.
-Podrażnienia w układzie trawiennym, powodując wrzody żołądkowe lub jelita.
-Zapalenie skóry
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Chlorek chrom (III). Źródło: w:.Wikipedia.org
- Chlorek chromu (III) [PDF]. Odzyskane z: alfa.Chem.Umb.Edu
- Pubchem. (2019). Chlorek chlorek heksahydrat. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- National Institute of Health. (21 września 2018 r.). Chrom: arkusz informacyjny suplementu diety. Źródło: SDG.Od.Nih.Gov
- Tomlinson Carole a. (2019). Działania uboczne chlorku chromu. Leaf Group Ltd. Odzyskane od: zdrowo.com
- « Dlaczego ważne jest czytanie? 10 korzyści z czytania
- Historia, struktura, właściwości, zastosowania, synteza, ryzyko »

