Charakterystyka galaktozydazy beta, struktura, funkcje
- 844
- 236
- Filip Augustyn
Galaktozydaza beta, Nazywany także β-galaktozydazą lub β-D-galaktohydolise jest enzymem należącym do rodziny hydrolaz glikosilowych zdolnych do hydrolizowania odpadów galaktozylowych różnego rodzaju cząsteczek: polimery, oligosacharydy i wtórne metabolity, między innymi.
Wcześniej znany jako „laktaza”, jego rozkład, a także rozkład polisacharydów oligo- i β-galaktyczności. Występuje w bakteriach, grzybach i drożdżach; W roślinach jest to powszechne w migdałach, brzoskwinie, morelach i jabłkach, a u zwierząt występuje w narządach takich jak żołądek i jelita.
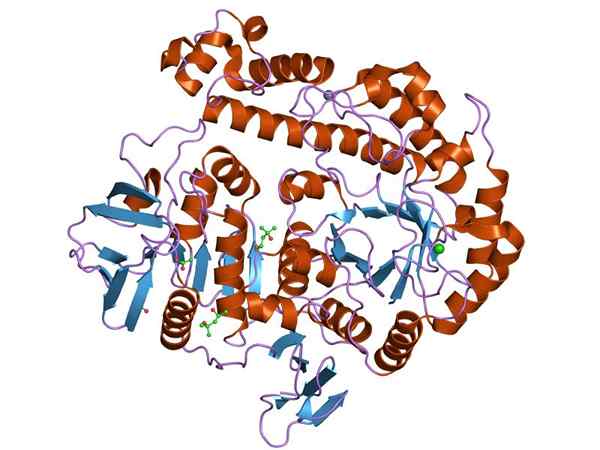
 Graficzne przedstawienie struktury enzymu B-galaktozydazy (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons)
Graficzne przedstawienie struktury enzymu B-galaktozydazy (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) Najczęściej badanym enzymem jest opeon GUMILAKA z I. coli, Gen zakodowany Lacz, którego badania były kluczem do zrozumienia funkcjonowania operatów genetycznych i wielu ich aspektów regulacyjnych.
Obecnie należy do najlepszej grupy enzymatycznej, a ich najbardziej znaną funkcją jest hydroliza glukozydowych linków laktozy. Wypełnia niezbędne funkcje metaboliczne w organizmach, które je wyrażają i jest również używane w różnych celach przemysłowych.
Wśród zastosowań przemysłowych jest usunięcie laktozy produktów mlecznych dla osób nietolerujących laktozy i produkcja kilku związków galaktywności. Są również używane do poprawy słodyczy, smaku i trawienia wielu produktów mlecznych.
[TOC]
Charakterystyka
Oprócz substratów galaktywności, takich jak laktoza, większość znanych β-galaktozydaz wymaga jonów metalicznych, takich jak magnez i sód. Udowodniono to wraz z odkryciem miejsc związkowych dla tych metali w jego strukturze.
Β-galaktozydy obecne w naturze mają wiele różnych zakresów pH, do których mogą działać. Enzymy grzybicze działają w środowiskach kwasowych (2.5 do 5.4), podczas gdy drożdże i bakterie działają między 6 a 7 jednostkami pH.
Może ci służyć: gramowe bakterieβ-galaktozydas bakteryjny
Bakterie mają duże enzymy galato-hydrolityczne w porównaniu z innymi analizowanymi galaktozydami. W tych organizmach ten sam enzym katalizuje trzy typy reakcji enzymatycznych:
- Hydroliza laktoza do swoich konstytutywnych monosacharydów: galaktozę i glukozę.
- Katalizuje transgastilowanie laktozy do alolaktozy, cukru disacharydowego, który uczestniczy w pozytywnej regulacji ekspresji genów należących do opeone GUMILAKA, Eç.
- Hydrolizuje alolaktozę podobną do tego, jak to działa z laktozą.
Grzyb β-galaktozydów
Grzyby mają enzymy β-galaktozydazy bardziej podatne na hamowanie galaktozy niż enzymy należące do innych organizmów. Są one jednak termostabilne i działają w kwasowych zakresach pH.
Metabolizm laktozy za pośrednictwem tych enzymów w grzybach jest podzielony na pozakomórkowe i cytozolowe.
Struktura
Enzym β-galaktozydazy bakterii jest enzymem tetramerycznym (czterech identycznych podjednostek, A-D), a każdy z jego monomerów ma więcej niż 1.000 odpadów aminokwasowych, co oznacza masę cząsteczkową ponad 100 kDa dla każdego i więcej niż 400 kDa dla złożonego białka.
W przypadku roślin, wręcz przeciwnie, enzym jest znacznie mniejszy i można go powszechnie znaleźć jako dimer identycznych podjednostek.
Domeny każdego monomeru wyróżniają się liczbami od 1 do 5. Domena 3 ma strukturę lufy α/β „TIM” i ma miejsce aktywne na C-końcowym końcu lufy.
Może ci służyć: organogeneza zwierząt i roślin oraz jej cechyZakłada się, że aktywne miejsca kompleksu enzymatycznego są wspólne między monomerami, więc enzym ten jest biologicznie aktywny tylko wtedy, gdy jest kompleksowy jako tetrametr.
Jego aktywna strona ma możliwość dołączenia D-glukozy i d-galaktozy, dwóch monosacharydów, które tworzą laktozę. Jest to szczególnie specyficzne dla d-galaktozy, ale nie jest tak bardzo w przypadku glukozy, więc enzym może działać na innych galaktozydach.
Funkcje
U zwierząt
W jelicie ludzi główna funkcja tego enzymu ma związek z wchłanianiem laktozy połkniętej pokarm.
Ponadto wykazano, że izoformy lizosomalne tego enzymu uczestniczą w degradacji wielu glucoolipidów, mukopolisacharydów i glikoproteinów galaktywności, które mają wiele celów na różnych trasach komórkowych.
W roślinach
Rośliny mają enzymy β-galaktozydazy na liściach i nasionach. Wypełniają one ważne funkcje w katabolizmie galaktolipidów, które są charakterystyczne dla glonów i roślin w ogóle.
W tych organizmach β-galaktozydaza uczestniczy w procesach wzrostu roślin, dojrzewaniu owoców, a w górnych roślinach jest to jedyny znany enzym zdolny do hydrolizowania odpadów galaktozylowych z polisacharyd.
W branży i badaniach
W przemyśle spożywczym związanym z produktami mlecznymi enzym β-galaktozydazy służy do katalizowania hydrolizy laktozy obecnej w produktach mlecznych, która jest odpowiedzialna za wiele wad związanych z przechowywaniem tych produktów.
Hydroliza tego cukru ma na celu uniknięcie sedymentacji cząstek, krystalizacji zamrożonych deserów mlecznych i obecności „piaszczystych” tekstur w większości komercyjnych pochodnych mleka.
Może ci podać: Ziemia łańcuch pokarmowy: linki i przykładΒ-galaktozydaza, która jest stosowana przemysłowo, jest zwykle uzyskiwana z grzyba Aspergillus sp., Chociaż enzym wytwarzany przez drożdże Kluyveromyces lactis Jest również szeroko stosowany.
Aktywność β-galaktozydazy, która przekłada się na terminy naukowe, takie jak „fermentacja laktozy”, jest rutynowo testowana pod kątem identyfikacji Grama ujemnych enterobakterii obecnych w różnych typach próbek.
Ponadto, w kategoriach medycznych, jest stosowany do produkcji nabiału bez laktozy i do preparatu tabletek używanych przez osoby nietolerujące laktozy do trawienia mleka i ich pochodnych (jogurt, ser, lody, masło, kremy itp.).
Jest stosowany jako „bioczujniki” lub „biomarker” o różnorodności celów, od testów immunologicznych i analizy toksykologicznej po analizę ekspresji genów i diagnozę patologii dzięki chemicznemu unieruchomieniu tego enzymu w specjalnych wsparcia w specjalnym wsparciu.
Bibliografia
- Henrissat, ur., & Daviest, G. (1997). Strukturalna i oparta na sekwencji klasyfikacja hydrolów glikozydowych. Obecna biologia, 7, 637-644.
- Huber, r. (2001). Beta (b) -galaktozydaza. Academic Press, 212-214.
- Husain, q. (2010). β galaktozydaese i ich potencjalne zastosowania: przegląd. Krytyczne recenzje w biotechnologii, 30, 41-62.
- Sędzia, d. H., Matthews, ur. W., & Huber, r. I. (2012). LACZ B-galaktozydaza: struktura i funkcja enzymu o historycznym i molekularnym znaczeniu biologicznym. Białko naukowe, dwadzieścia jeden, 1792-1807.
- Lee, ur. I., Han, J. DO., Im, J. S., Morrone, a., Johung, k., Goodwin, c.,… Hwang i. S. (2006). Β -galaktozydaza, olbrzyma starzenia. Starzejąca się komórka, 5, 187–195.
- Matthews, ur. W. (2005). Struktura E. β-galaktozydaza coli. C. R. Biologie, 328, 549-556.
- McCarter, J. D., & Withers, s. G. (1994). Mechanizmy enzymatycznej hydrolizy glikozydu. Obecna opinia w biologii strukturalnej, 4, 885-892.
- Richmond, m., Gray, J., & Stine, c. (1981). Beta-galaktozydaza: przegląd najnowszego zastosowania technologicznego, problemów żywieniowych i unieruchomienia. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, r. (1972). B-galaktozydaza.

