Historia berylum, struktura, właściwości, użycia

- 2048
- 322
- Herbert Wróblewski
On beryl Jest to element metaliczny, który należy do grupy 2 lub IIA stolika okresowego. Jest to najbardziej lekki metal alkaliczny w grupie i jest reprezentowany przez symbol be. Jego atom i kation są również mniejsze niż ataki ich rówieśników (MG, CA, MR ...).
Ze względu na jego niezwykłą gęstość obciążenia, metal ten zwykle nie występuje w izolacji. Znają około 30 minerałów, które go zawierają, wśród których: beryl (3beo · al2ALBO3· 62· 2H2O), Bertrandita (4beo.2se2.2h2O), El Chrisoberilo (Beal2ALBO4) i fenaquita (bądź2Tak4).
 Metalliczne beryll pipitas. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Metalliczne beryll pipitas. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] La Esmeralda, kamień szlachetny, jest wariantem beryl. Jednak czyste berylum nie jest tak uderzające; Wygląda jasnorejistyczna jasność (lepszy obraz) i został osiągnięty w postaci pepitas lub dragees.
Beryl ma zestaw charakterystycznych właściwości fizycznych. Ma niską gęstość; Wysokie zachowanie termiczne i elektryczne, a także jego pojemność cieplną i rozpraszanie ciepła; To nie jest metal magnetyczny; a także ma odpowiednią kombinację sztywności i elastyczności.
Wszystkie te właściwości doprowadziły do tego, że berylum jest metalem z wieloma zastosowaniami, od jego zastosowania w stopach miedzi do opracowania narzędzi, do jego zastosowania w rakietach, samolotach, samochodach, reaktorach jądrowych, sprzęcie X -shay, rezonans jądrowym itp. .
Beryl ma 10 znanych izotopów, od 5Być 14Być będąc 9Być jedynym stabilnym. Jest to również bardzo toksyczny metal, który szczególnie wpływa na układ oddechowy, więc istnieje ograniczenie jego użycia.
[TOC]
Historia twojego odkrycia
Beryl został odkryty przez Louisa-Nicolasa Vauguelin w 1798 r.
Następnie niemiecki chemik Frederic Wöhler w 1828 r. Udało się odizolować beryl, reagując potas z chlorkiem berylu w platynowej garnku.
Jednocześnie i niezależnie, francuski chemik Antoine Bussy również osiągnął izolację Beryllium. Wöhler jako pierwszy zasugerował nazwę berylum na metal.
Otrzymał swoje obecne imię w 1957 roku, ponieważ był wcześniej znany jako glucynium, ze względu na słodki smak niektórych soli. Ale, aby uniknąć zamieszania z innymi związkami słodkiego smaku, a z rośliną o nazwie Glucina postanowiono zmienić nazwę Berylum.
Struktura domina
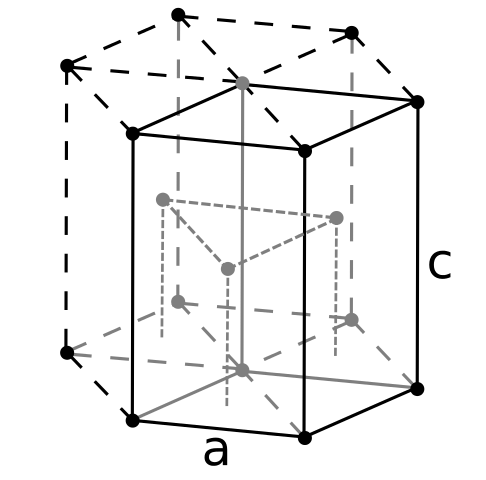 Struktura Crign Burely. Źródło: Użytkownik: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Struktura Crign Burely. Źródło: Użytkownik: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Będąc berylowym najlżejszym z metali alkalicznych, należy oczekiwać, że objętość jego atomów będzie najmniejsza ze wszystkich. Atomy berylilu oddziałują ze sobą poprzez wiązanie metaliczne, tak że ich „morze elektronów” i odpychanie między jądrem modelują powstałą strukturę szklaną.
Może ci służyć: kwas periódinowy (Hio4): co to jest, struktura, właściwości, używaNastępnie tworzone są czarne kryształy berylum. Kryształy te mają sześciokątną strukturę (obraz doskonały), w której każdy z nich ma sześciu bocznych sąsiadów i trzy inne w samolotach górnych i w dół.
Będąc czarnymi kryształami, jest to przydatne. Jest to jedna z najbardziej zwartych struktur, jakie metal może przyjąć; I ma sens, że tak małe atomy były „ściśnięcie”, aby uniknąć najmniejszej pustki lub liczby otworów między nimi.
Elektroniczna Konfiguracja
1s22s2
Co jest równe 4 elektron, z czego 2 pochodzą z Walencji. Jeśli promowany zostanie elektron do orbity 2p, będą miały dwa orbitale sp HBíbridos. Zatem w związkach berylu mogą występować geometrie liniowe, x-be-x; Na przykład izolowana cząsteczka BECL2, Cl-be-cl.
Nieruchomości
Opis fizyczny
Solidny szary, jasny i kruche kolor.
Temperatura topnienia
1287 ° C.
Punkt wrzenia
2471 ºC.
Gęstość
- 1 848 g/cm3 w temperaturze pokojowej.
- 1,69 g/cm3 do temperatury topnienia (stan płynny).
Radio atomowe
112 PM.
Radio Kowalencyjne
90 PM.
Objętość atomowa
5 cm3/mol.
Ciepło właściwe
1 824 J/g · mol w 20 ° C.
Fusion Heat
12.21 kJ/mol.
Ciepło parowania
309 kJ/mol.
Elektronialiczność
1.57 na skali Pauling.
Standardowy potencjał
1,70 v.
Prędkość dźwięku
12.890 m/s.
Rozszerzalność cieplna
11,3 µm/m · k w 25 ° C.
Przewodność cieplna
200 w/m · k.
Właściwości chemiczne
Beryl jest pokryty warstwą tlenku berylu (pszczoły), która służy jako ochrona powietrza w temperaturze pokojowej. Utlenianie berylu występuje w temperaturach większych niż 1000 °.
Jest również odporny na działanie kwasu azotowego 15 m. Ale rozpuszcza się w kwasie solnym i alkalicznym, takim jak wodorotlenek sodu.
Aplikacje
Przygotowanie narzędzi
Berylu tworzy stopy z miedzią, niklem i alumino. W szczególności stop z miedzią wytwarza narzędzia o wielkiej twardości i oporności, stanowiąc tylko 2% masy stopu.
Narzędzia te nie wytwarzają iskier podczas uderzenia w żelazo, co umożliwia je do użytku w środowiskach o wysokiej zawartości gazów palnych.
Może ci służyć: termiczna: struktura, charakterystyka, formacja, przykładyZe względu na niską gęstość ma lekką wagę, która wraz z sztywnością pozwala na wykorzystanie w kosmicznych samolotach, rakietach, pociskach i samolotach. Stop z berylum został użyty w opracowaniu części samochodowych. Został również używany w Springs Opracowanie.
Ze względu na wielką twardość nadaną przez Beryl na jego stopach, zostały one wykorzystane w hamulcach samolotów wojskowych.
Opracowanie luster
Berylu zastosowano do produkcji luster ze względu na jego stabilność wymiarową i zdolność do posiadania wysokiego pultera. Te lustra są używane w satelitach i systemach kontroli ognia. Ponadto używane są teleskopy kosmiczne.
W promieniowaniu jonizującym
Beryl jest elementem o niskiej gęstości, więc można go uznać za przezroczyste dla x -kart. Ta funkcja pozwala na wykorzystanie w konstrukcji okien rur, które wytwarzają X -Kasu, zastosowanie przemysłowe i diagnozę medyczną.
Podobnie beryl jest używany w oknach detektorów emisji radioaktywnej.
W zespołach generujących magnetyzm
Wśród cech berylu nie jest to element magnetyczny. Pozwala to na stosowanie go w budowie artykułów ze sprzętu do rezonansu magnetycznego, w których generowane są pola magnetyczne o dużej intensywności, minimalizując wszelkie zakłócenia.
Reaktor nuklearny
Ze względu na swój wysoki punkt fuzji znalazł zastosowanie w reaktorach jądrowych i ceramice. Beryl jest stosowany jako moderator reakcji jądrowych i jako producent neutronów:
9Być + 4On (α) => 12C +N (neutron)
Szacuje się, że w przypadku miliona atomów berylowych, które są bombardowane cząsteczkami α, występują do 30 milionów neutronów. Dokładnie ta reakcja jądrowa pozwoliła na odkrycie neutronów.
James Chadwick bombardował atomy berylum cząstkami α (He). Badacz zaobserwował uwalnianie cząstek subátomowych, bez ładunku elektrycznego, co doprowadziło do odkrycia neutronów.
Metal Protector
Dodaj ilość berylu na powierzchni metali, które można utlenić, nadaje pewną ochronę. Na przykład łatwość magnezu jest zmniejszona, a jasność stopów srebra jest przedłużona.
Gdzie to się znajduje?
Beryl znajduje się w pegmatycie, związany z miką, skaleniem i kwarcem. Dzięki zastosowaniu techniki flotacji można oddzielić mieszankę beryl i skalenia. Następnie skalenie i beryl są skoncentrowane i poddawane leczeniu hipochlorytem wapnia.
Może ci służyć: różnice między związkami organicznymi i nieorganicznymiA następnie obróbka kwasem siarkowym i sulfonianem potasu, poprzez rozcieńczenie osiąga się flotację berylową, oddzielając go od skalenia.
Beryl traktuje się fluorosylianem sodu i sodą w temperaturze 770 °. Następnie wytrąca się wodorotlenek wodorotlenku wodorotlenku wodorotlenku sodu.
Fluorek berylu powstaje przez reakcję wodorotlenku berylu z fluorem wodorem amoniakowym, wytwarzając amonowy amon. Jest to ogrzewane, tworząc fluor berylu, który jest traktowany gorącym magnezem w celu izolowania berylu.
Ryzyko
Beryl jako drobno podzielony metal, w postaci roztworów, suchy kurz lub dym, jest bardzo toksyczny i może wytwarzać zapalenie skóry. Jednak największa toksyczność wytwarza się przez inhalację.
Początkowo berylu może wywoływać nadwrażliwość lub alergię, które mogą stać się bellioza lub przewlekłą chorobę berylu (CBD). Jest to poważna choroba, charakteryzująca się spadkiem pojemności płuc.
Ostra choroba jest rzadka. W chorobie przewlekłej występuje tworzenie się faruloma w całym ciele, szczególnie w płucach. Przewlekła bellioza powoduje postępującą duszność, kaszel i ogólne osłabienie (astenia).
Ostra bellioza może być śmiertelna. W Belliozie występuje postępująca utrata funkcji oddechowej, ponieważ występuje niedrożność przepływu dróg oddechowych w dróg oddechowych i zmniejszone natlenienie ciśnienia krwi krwi.
Bibliografia
- Royal Society of Chemistry. (2019). Beryl. Odzyskane z: RSC.org
- National Center for Biotechnology Information. (2019). Beryl. Baza danych Pubchem. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Helmestine, Anne Marie, pH.D. (15 marca 2019 r.). Fakty berylum. Odzyskane z: Thoughtco.com
- Wikipedia. (2019). Beryl. Źródło: w:.Wikipedia.org
- Lentech b. V. (2019). Beryl-be. Odzyskane z: lentech.com
- Materiał korporacyjny. (2019). Dowiedz się o elemencie Berylu odzyskane z: berylum.com
- D. Michaud. (12 kwietnia 2016 r.). Problem z przetwarzaniem i ekstrakcją berylu. 911 metalurga. Odzyskane z: 911metalurgist.com
- Timothy p. Hanusa. (5 stycznia 2016). Beryl. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Czytaj s. Nowego człowieka. (2014). Choroba berylum. Podręcznik MSD. Odzyskane z: msdmanuals.com
- « Historia psychologii sportowej, cele i profile
- Globalizacja społeczna wymiar społeczny, zalety i przykłady »

