Historia benzenu, struktura, właściwości, pochodne, zastosowania

- 3265
- 445
- Eugenia Czapla
On benzen Jest to związek organiczny, który składa się z jednego z najprostszych węglowodorów aromatycznych. Jego formuła chemiczna to c6H6, z których wiadomo, że związek między węglem a wodorem jest równy 1; to znaczy dla każdego węgla jest z tym powiązany wodór.
Chociaż jego wygląd fizyczny jest wygląd bezbarwnej cieczy, naturalnie znajduje się w oleju i produktach pochodzących z niego. Jego zapach jest bardzo charakterystyczny, ponieważ przypomina mieszankę kleju, bitumu i benzyny; Z drugiej strony jest to niestabilna i łatwopalna ciecz.
 Belfing z benzenem. Źródło: AIR1404 [CC do 4.0 (https: // creativeCommons.Org/licencje/według/4.0)]
Belfing z benzenem. Źródło: AIR1404 [CC do 4.0 (https: // creativeCommons.Org/licencje/według/4.0)] Na górnym obrazie pokazano pojemnik lub butelkę z benzenem, prawdopodobnie o czystości nieanalitycznej. Jeśli opary benzenowe zostaną natychmiast odkryte w całym laboratorium. Z tego powodu ta ciecz, powszechnie stosowana jako prosty rozpuszczalnik, jest manipulowany w dzwonku wyciągającego gaz.
Będąc twoją formułą C6H6, Dziewiętnaste chemikalia podniosły wiele możliwych struktur, które odpowiadają wspomnianej proporcji C/H równej 1. Nie tylko to, ale cząsteczka benzenu musiała mieć specjalne powiązania w taki sposób, aby jej niezwykła stabilność można było wyjaśnić reakcjom dodawania; typowe dla alkenów i polityk.
Tak było tak, aby jego powiązania reprezentowały zagadkę dla chemikaliów tamtych czasów; Dopóki nieruchomość zadzwoniła aromatyczność. Zanim uważa się za heksacyklotrien (z trzema wiązaniami c = c), benzen jest znacznie więcej i jest to kolejny z wielu przykładów synergii w chemii.
W chemii organicznej benzen jest klasycznym symbolem, podstawą strukturalną dla wielu związków polilaromatycznych. Z jego sześciokąta symfiny pochodnych uzyskuje się poprzez aromatyczne podstawienie elektrofilowe; Pierścień, którego krawędzie graniczy ze strukturą, która definiuje nowe związki.
W rzeczywistości jego pochodne są winne ogromne zastosowania przemysłowe dla tych, którzy potrzebują benzenu wśród swoich surowców. Od przygotowania kleju tekstylnego i włókien, po tworzywa sztuczne, gumy, pigmenty, narkotyki i materiały wybuchowe. Z drugiej strony naturalnie benzen znajduje się w wulkanach, pożarach lasów, benzynie i dymu papierosów.
[TOC]
Historia
Odkrycie i nazwy
Jego odkrycie pochodzi z 1825 r. Ta ciecz zawierała proporcję C/H zbliżoną do 1, dlatego nazwał ją „wodorem gaźnikiem”.
Chemik Auguste Laurent mianował dziwne węglowodorowe „feno”, pochodzące od greckiego słowa ”Phaínein„Co oznacza genialne (ponieważ uzyskano go po spalonym gazie). Jednak nazwa ta nie została zaakceptowana przez społeczność naukową i dominowała tylko jako „fenyl”, odnosząca się do radykalnego pochodzącego z benzenu.
Z gumy benzoinowej chemika Eilharda Mitscherlicha, dziewięć lat później, udało się wyprodukować ten sam związek; Dlatego było inne źródło tego samego węglowodoru, które ochrzcił jako „Benzina”. Jednak nie rozważali również odpowiedniej nazwy do założenia, że był to alkaloid, taki jak chinina.
W ten sposób zastąpili nazwę „Bencina” przez „benzol”. Jednak znów wystąpiły sprzeczności i rozbieżności, ponieważ termin „benzol” pomieszał węglowodór dla alkoholu. Wtedy urodziła się nazwa „Benzene”, najpierw używana we Francji i Anglii.
Może ci służyć: węglan litowy (LI2CO3): Struktura, właściwości, zastosowaniaProdukcja przemysłowa
Ani gaz oświetleniowy, ani guma benzoiny nie były odpowiednim źródłami do generowania benzenu do dużych skal. Charles Mansfield, współpracujący z Augustem Wilhelmem von Hofmann, osiągnięty w 1845 r.
Tak więc produkcja przemysłowa benzenu rozpoczęła. Dostępność benzenu w ogromnych ilościach, ułatwiła badanie jego właściwości chemicznych i pozwoliła mu powiązać z innymi związkami o podobnej reaktywności. August Wilhelm von Hofmann ukuł słowo „aromatyczny” dla benzenu i powiązanych związków.
Struktury historyczne
Marzenie Augusta Kekulé
Friedrich Augul Kekulé otrzymuje sześciokątną i cykliczną strukturę benzenu około 1865. Uważał zatem, że benzen można uznać za pierścień sześciokątny, a inne chemikalia podnieśli możliwe struktury, które pokazano poniżej:
 Struktury pierścieni benzenu zaproponowane w całej historii. Źródło: Jü [domena publiczna]
Struktury pierścieni benzenu zaproponowane w całej historii. Źródło: Jü [domena publiczna] Niektóre górne struktury mogą uzasadnić stabilność benzenu.
Książka, pierścionki i pryzmat
Zauważ, że trzecia struktura nie jest nawet pierścieniem, ale trójkątny pryzmat, zaproponowany przez Alberta Ladenburga w 1869 r.; Po jego lewej stronie, w kształcie otwartej książki, zaproponowanej przez Sir Jamesa Dewara w 1867 r.; A po jego prawej stronie, jeden ze wszystkimi hydrogenami skierowanymi w kierunku środka pierścienia, zaproponowanego przez Henry'ego Edwarda Armstronga w 1887 roku.
Pierwsza struktura, zaproponowana przez Adolfa Karla Ludwiga Clausa w 1867 r., Jest również dość szczególna, ponieważ łącza C-C są skrzyżowane. A ostatnim był pierścionek Kekulé „Serpentine”, marzył w 1865 roku.
Jaki był „zwycięzca”? Piąta struktura (od lewej do prawej), zaproponowana w 1899 roku przez Johannesa Thiele.
W tym hybryda rezonansu została rozważona po raz pierwszy, która połączyła dwie struktury Kekulé (obrócił pierwszy pierścień po prawej, aby go obserwować) i wyjaśniła wyjątkowo przeniesienie elektronów, a wraz z nimi do tej pory nietypowa stabilność z powodu tego Benzen.
Struktura benzenu
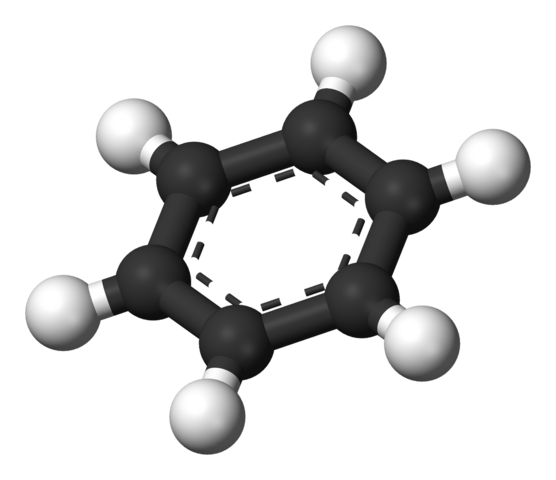 Pierścień aromatyczny benzenu. Źródło: Benjah-BMM27 [domena publiczna]
Pierścień aromatyczny benzenu. Źródło: Benjah-BMM27 [domena publiczna] Struktura zaproponowana przez Thiele jest pokazana przez model kul i słupków.
Cząsteczka benzenu jest płaska, a atomy wodoru wskazują na boki pierścienia. Wszystkie atomy węgla mają hybrydyzację SP2, Z orbitalą P Dostępne w celu ustalenia układu aromatycznego, w którym przenosi sześć elektronów.
Te Carbonos sp2 Są bardziej elektroongenacyjne niż hydrogeny, a zatem pierwsza przesunięcie gęstości elektronicznej do tego ostatniego (cSP2δ--Hδ+). W konsekwencji środek pierścienia ma większe stężenie elektronów niż jego boki.
Mówiąc dokładniej, układ aromatyczny może być reprezentowany jako chmurka lub podkładka elektroniczna rozszerzona po obu stronach pierścienia sześciokątnego; a pośrodku, po bokach lub krawędziach, niedobór elektroniczny utworzony przez hydrogeny z dodatnim obciążeniem częściowym.
Dzięki temu rozkładowi ładunków elektrycznych cząsteczki benzenowe mogą oddziaływać ze sobą poprzez siły dipola-dipolo; Atomy hδ+ Czują pociąg do aromatycznego centrum sąsiedniego pierścienia (poniżej będzie reprezentowane).
Podobnie centra aromatyczne można ułożyć jeden na drugim, aby sprzyjać indukcji natychmiastowych dipoli.
Może ci służyć: alotropiaRezonans
 Struktury i rezonans hybryda benzenu. Źródło: Edgar181 z Wikipedii.
Struktury i rezonans hybryda benzenu. Źródło: Edgar181 z Wikipedii. Dwie struktury Kekulé są pokazane u góry obrazu, a pod nimi hybryda rezonansowa. Gdy dwie struktury powtarzają się w tym samym czasie, hybryda jest reprezentowana z okręgiem narysowanym na środku (podobnie jak „sześciokątny pączek”).
Koło hybrydowe jest ważne, ponieważ wskazuje na aromatyczny charakter benzenu (i wielu innych związków). Ponadto wskazuje, że linki nie są tak długie, jak C-C, ani tak krótkie jak C = C; ale ich długość jest między obiema końcami. Zatem benzen nie jest uważany za polenhen.
Powyższe zostało wykazane przez pomiar długości łączy C-C (139 pm) benzenu, które są nieco bardziej wydłużone niż wiązania C-H (109 pm).
Kryształy
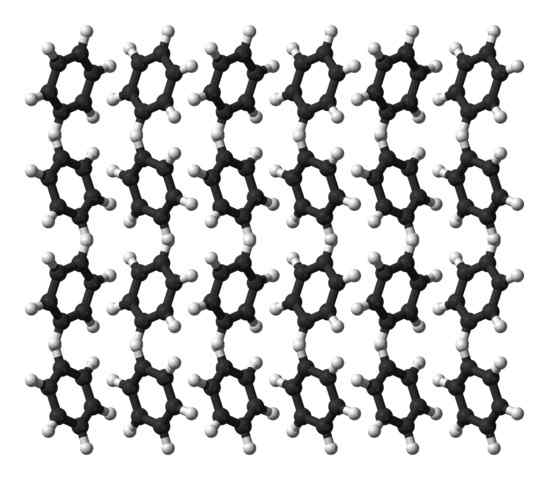 Benzen Ortorrombic Struktura krystaliczna. Źródło: Ben Mills [domena publiczna]
Benzen Ortorrombic Struktura krystaliczna. Źródło: Ben Mills [domena publiczna] Benzen jest płynem w temperaturze pokojowej. Jego siły międzycząsteczkowe wytwarzają, pomimo tak wyraźnego momentu dipolowego, może utrzymywać swoje cząsteczki razem w cieczy, która wrze w wysokości 80ºC. Gdy temperatura spadnie poniżej 5ºC, benzen zaczyna zamarznąć: i dlatego otrzymuje się ich odpowiednie kryształy.
Pierścienie benzenowe mogą przyjmować wzorce strukturalne zdefiniowane w ich stałym. Ich dipole sprawiają, że są „przechylone” w lewo lub w prawo, tworząc stopnie zdolne do odtworzenia przez ortorrombiczną komórkę. Zatem kryształy benzenowe są ortorombowe.
Zwróć uwagę na lepszy obraz, że gdy pierścienie są skłonne do faworyzowania interakcji między Hδ+ i centra aromatyczne, wspomniane w poprzednich podsekcjach.
Nieruchomości
Masa cząsteczkowa
78 114 g/mol.
Wygląd fizyczny
Bezbarwny ciecz z zapachem podobnym do benzyny.
Punkt wrzenia
80ºC.
Temperatura topnienia
5,5ºC.
punkt zapłonu
-11ºC (zamknięty kubek).
Temperatura samowystarczalności
497,78ºC.
Gęstość
0,8765 g/ml w 20ºC.
Rozpuszczalność
Litr wrzącej wody ledwo rozpuści 3,94 g benzenu. Jego apolowy charakter sprawia, że jest praktycznie niemieszczony z wodą. Jest jednak mieszany z innymi rozpuszczalnikami, takimi jak etanol, eterę, aceton, oleje, chloroform, tetrachlor węglowy itp.
Gęstość pary
2.8 w relacji powietrznej (to znaczy prawie trzy razy więcej).
Ciśnienie pary
94,8 mm Hg w 25ºC.
Ciepło spalania
-3267,6 kJ/mol (dla ciekłego benzenu).
Ciepło parowe
33,83 kJ/mol.
Napięcie powierzchniowe
28,22 mn/m 25ºC.
Współczynnik załamania światła
1 5011 do 20ºC.
Pochodne

Hydrogeny benzenowe można zastąpić innymi grupami lub atomami. Może istnieć jedno lub więcej podstawień, zwiększając stopień podstawienia do sześciu oryginalnych hydrogenów.
Na przykład Benceno jako pH-H, gdzie H jest dowolnym z sześciu hydrogenów. Pamiętając, że środek pierścienia ma większą gęstość elektroniczną, przyciąga elektrofile, które atakują pierścień w celu zastąpienia H w reakcji zwanej aromatycznymi podstawieniem elektrofilowym (SEAR).
Jeśli H zostanie zastąpione przez OH, ph-OH, fenol będzie miał; zastępując Cho3, Ph-ch3, Toluen; Jeśli to NH2, Ph-nh2, anilina; Lub jeśli to Cho2Ch3, Ph-ch2Ch3, Etylobenzen.
Pochodne mogą być takie same lub bardziej toksyczne niż benzen lub wręcz przeciwnie, stać się tak złożone, że stają się pożądanym efektem farmakologicznym.
Może ci służyć: węglika wapnia (CAC2): struktura, właściwości, uzyskiwanie, zastosowaniaAplikacje
Jest to dobry rozpuszczalnik dla szerokiej gamy związków, na przykład w obrazach, lakierach, klejach i powłokach.
Może również rozpuszczać oleje, tłuszcze lub woski, dzięki czemu był używany jako rozpuszczalnik ekstraktora esencji. Ta właściwość została wykorzystana przez Ludwiga Roseliusa w 1903 roku do spękania kawy, operacji już nieużywanej z powodu toksyczności benzenu. Podobnie, w przeszłości był używany do odtłuszczania metali.
W jednym z swoich klasycznych zastosowań nie działa jako rozpuszczalnik, ale jako addytywny: zwiększ oktan benzyny, zastępując ołowiu w tym celu.
Pochodne benzenu mogą mieć różne zastosowania; Niektóre służą jako pestycydy, smary, detergenty, tworzywa sztuczne, materiały wybuchowe, perfumy, barwniki, klej, leki itp. Jeśli w jego strukturze znajduje się pierścień benzeniczny, jest całkiem prawdopodobne, że jego synteza pozostawiła benzen.
Wśród jego najważniejszych pochodnych są: cumeno, ksylen, anilin, fenol (dla syntezy żywic fenolowych), kwas benzoesowy (konserwujący), cykloheksan (do syntezy nilonu), nitrobenzen, resorcynol i etylobenzen.
Nomenklatura
Nomenklatura pochodnych benzenu różni się w zależności od stopnia podstawienia, jakie są grupy zastępcze i ich względne pozycje. W ten sposób benzen może cierpieć małpa, di, tri, tetra itp., Zastępstwa
Gdy dwie grupy są powiązane z sąsiednimi węgliami, stosuje się denominację „orto”; Jeśli istnieje węgiel pomiędzy rozdzieleniem ich, „cel”; A jeśli węglowodany znajdują się w przeciwnych pozycjach, „dla”.
Na niższych obrazach pokazano przykłady pochodnych benzenu z ich odpowiednimi nazwami rządzonymi przez IUPAC. Towarzyszą im również wspólne lub tradycyjne nazwy.
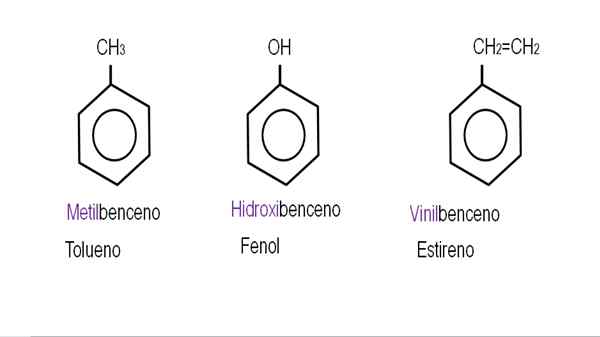 Monoderywowany benzen. Źródło: Gabriel Bolívar.
Monoderywowany benzen. Źródło: Gabriel Bolívar. 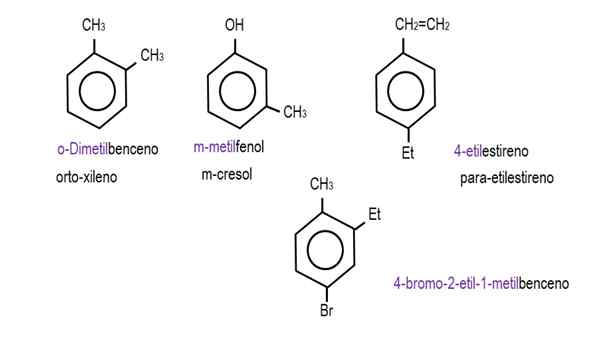 Inne pochodne benzenu. Źródło: Gabriel Bolívar.
Inne pochodne benzenu. Źródło: Gabriel Bolívar. Zwróć uwagę, że w trojakie benzenu wskaźniki orto, ponieważ i cel przestają być przydatne.
Toksyczność
Benzen jest związek, który należy dokładnie manipulować. Biorąc pod uwagę jego szczególny zapach, natychmiastowe negatywne skutki mogą być uduszenie, zawroty głowy, bóle głowy, drżenie, senność, nudności, a nawet śmierć (przed dużą ekspozycją). Jeśli oprócz tego, co już wspomniano, bóle żołądka i napady mogą spowodować ostre.
Ponadto długoterminowe skutki pod stałym narażeniem na tę ciecz są rakotwórcze; Zwiększa szanse, że jednostka cierpi na pewien rodzaj raka, zwłaszcza krew: białaczka.
We krwi może zmniejszyć stężenie czerwonych krwinek, powodując niedokrwistość, a także wpływać na szpik kostny i wątrobę, gdzie jest zasymilowane przez ciało w celu wytworzenia jeszcze bardziej toksycznych pochodnych benzenu; Na przykład hydroksykwiinon. Gromadza się także w nerkach, sercu, płucach i mózgu.
Bibliografia
- Morrison, r.T. I Boyd, r. N. (1987). Chemia organiczna. (Edycja 5). Addison-Wesley Iberoamericana.
- Carey, f. DO. (2008). Chemia organiczna. (6. edycja). McGraw-Hill, Intermerica, redakcje.DO.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- National Center for Biotechnology Information. (2019). Benzen. Baza danych Pubchem. CID = 241, odzyskany z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2019). Benzen. Źródło: w:.Wikipedia.org
- Garcia Nissa. (2019). Co to jest benzen? - Użycie, struktura i formuła. Badanie. Odzyskane z: Study.com
- Centra kontroli i zapobiegania chorobom. (4 kwietnia 2018 r.). Fakty o benzenie. Odzyskane z: nagły wypadek.CDC.Gov
- Światowa Organizacja Zdrowia. (2010). Ekspozycja na benzen: poważne obawy dotyczące zdrowia publicznego. [PDF]. Wyzdrowiał od: kto.int
- Fernández Germán. (S.F.). Problemy z nomenklatury benzenu. Chemia organiczna. Odzyskane z: Chemicicaorganica.org
- « Koncepcja kosmopolityzmu, pochodzenie, wizja Kanta, społeczeństwo
- Obiekt studiów, geografii turystycznej, pochodzenia, nauki pomocnicze »

