Szkolenie anion, cechy i typy
- 1682
- 66
- Gabriela Łuczak
A anion To wszystkie gatunki chemiczne o obciążeniu ujemnym, oprócz tego, że jest jednym z dwóch rodzajów istniejących jonów. Jego ujemne obciążenie wynika z faktu, że przedstawia nadmiar elektronów w porównaniu z neutralną postacią gatunku; Dla każdego dodatkowego elektronu jego obciążenie ujemne wzrasta w jednostce.
Obciążenie ujemne może być zlokalizowane w jednym lub większej liczbie atomów, a także pokryć jego wpływ na cząsteczkę w całości. Zgodnie z uproszczeniem, niezależnie od tego, gdzie obciążenie (-) jest uważane za anion dla całego gatunku, związku lub cząsteczki.
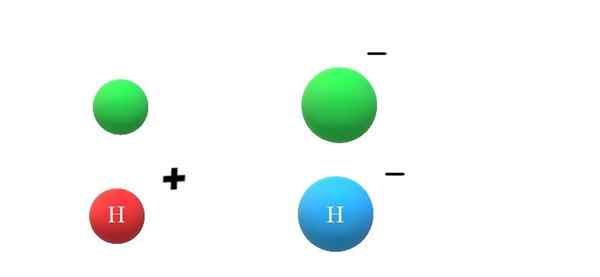
 Aniony. Źródło: Gabriel Bolívar.
Aniony. Źródło: Gabriel Bolívar. Jeśli gatunek neutralny wygra elektron, nadmiar obciążeń ujemnych objawia się w tworzeniu anionu x-, który będzie również miał wzrost promienia atomowego (obraz doskonały, z zielonymi kulkami). X i x- Różnią się znacznie swoimi właściwościami i tym, jak wchodzą w interakcje z otoczeniem.
Jeśli to jest teraz+ lub h-, odpowiednio. Kation h+ Jest to jon wodoru, zwany także protonem; i H- Jest to anion wodordu, najbardziej „prosty” ze wszystkich znanych anionów.
[TOC]
Szkolenie anionu
Tworzenie anionu można łatwo wyjaśnić w teorii; Chociaż eksperymentalnie może stać się wyzwaniem, zwłaszcza jeśli chcesz czyste, bez pozytywnych opłat przyciąganych do twoich negatywnych opłat.
Obciążenia formalne i mniej linków
Anion zostanie utworzony, gdy nastąpi nadmiar lub wzmocnienie elektronów w atomie. Zysk ten można ustalić, stosując obciążenia formalne w strukturze Lewisa. Ponadto, za pomocą poprzedniej metody, możesz dokładnie wiedzieć, jaki atom lub grupa z nich przychodzi obciążenie ujemne.
Może ci służyć: acetonitryl (C2H3N)Gdy atomy tworzą wiązania kowalencyjne, chociaż rozkład elektronów jest sprawiedliwy, może wystąpić częściowa utrata elektronów. W tym sensie mniej linków tworzą najbardziej elektroongenacyjne, bardziej wolne od elektronów par, a zatem wyświetlają obciążenia ujemne.
Rozważmy na przykład cząsteczkę amoniaku, NH3. NH3 Jest neutralny i dlatego nie ma opłat elektrycznych. Gdyby H został usunięty, to znaczy połączenie N-H zostało złamane, anion NH uzyskałby2-. Rysowanie struktury Lewisa i obliczanie formalnego obciążenia N, możesz to sprawdzić.
Po zerwaniu większej liczby linków N-H, teraz masz anion NH2-; i eliminując ostatnie H, anion n jest ostatecznie uzyskiwany3-, nazywany anionem nitruro. Azot nie ma już sposobu zyskania większej liczby elektronów, a jego obciążenie -3 jest najbardziej ujemne, jakie może dotrzeć; Jego orbitale nie dają więcej.
Redukcje
Anion może tworzyć produkt redukcji: zyskuje elektrony utleniające się do innego gatunku, który je traci. Na przykład tlen bardzo dobrze reprezentuje ten rodzaj reakcji chemicznej.
Gdy tlen jest zmniejszony, utleniony do innego gatunku i staje się anionem tlenku, lub2-; obecne w niezliczonych minerałach i związkach nieorganicznych.
Fizyczny
Atom może zyskać elektrony, jeśli znajduje się w fazie gazowej:
X (g) + e- => X-(G)
Ten sposób tworzenia anionu implikuje szeroką wiedzę na temat technik fizycznych, podczas gdy aniony gazowe nie są łatwe do zbadania, ani wszystkie gatunki są ulatnione ani rozpylane z prostotą fazy gazowej.
Charakterystyka
Ogólnie rzecz biorąc, typowe cechy anionu zostaną wymienione poniżej przed rozwiązaniem jego typów i przykładów:
-Jest bardziej nieporęczny niż neutralny atom.
Może ci służyć: dwutlenek chloru (CLO2): struktura, użycie, uzyskiwanie, ryzyko, właściwości-Może być mniej lub bardziej stabilny, pomimo rosnącego odpychania elektronicznego wśród własnych elektronów.
-Jeśli anion pochodzi z małego atomu elektroungatywnego, takiego jak węgiel, jest bardzo reaktywny.
-Ustaw mocne momenty dipolowe.
-Dalszy zwiększa interakcję z rozpuszczalnikami polarnymi.
-Anion monoatomiczny jest izolektroniczny do szlachetnego gazu z okresu; to znaczy ma w warstwie walencyjnej taką samą liczbę elektronów.
-Może polaryzować chmurę elektroniczną atomu sąsiedniego, odpychając zewnętrzne elektron.
Chłopaki
Monoatomic
Jak sama nazwa wskazuje, jest to anion, który składa się z jednego atomu: obciążenie ujemne jest dobrze położone. Każda grupa w tabeli okresowej ma charakterystyczne obciążenia ujemne; A ponieważ są oni, są to nie -metal znajdujący się w bloku p. Niektóre przykłady i ich nazwiska znajdują się poniżej:
-Cl-, chlorek.
-Siema-, ja ostatni.
-F-, fluorek.
-Br-, bromek.
-ALBO2-, tlenek.
-S2-, siarczek.
-ON2-, Seleniuro.
-Herbata2-, Teluroro.
-PO2-, Polyoniuro.
-N3-, NITRURO.
-P3-, Fosfuro.
-As3-, Arseniuro.
-Sb3-, Antimoniuro.
-C4-, węglik.
-Tak4-, Siliciuro.
-B3-, Boruro.
Oksoaniony
Oksoaniony charakteryzują się wiązaniem x = o, gdzie x może być dowolnym elementem niemetalicznym (z wyjątkiem fluoru) lub metalem (chrom, mangan, ect.). Mogą również mieć jedno lub proste linki X-O.
Niektóre oksoaniony o ich odpowiednich nazwach to:
-Clo-, podchloryn.
-brachu-, Hipobromito.
-Io-, hipoyodyt.
-Clo2-, Chloryn.
-Clo3-, chlorate.
-Io3-, Yodato.
-Clo4-, Perchloratu.
-PO43-, fosforan.
-WSPÓŁ32-, węglan.
-Cro42-, chromat.
-Cr2ALBO72-, Dicromato.
-południowy zachód42-, siarczan.
-S2ALBO32-, Tiosulfate.
-NIE3-, azotan.
-NIE2-, azotyn.
-Bo33-, Borate.
-Aso43-, Arseniato.
-PO33-, fosforyn.
-Mne4-, nadmanganian.
Organiczny
Cząsteczki organiczne mają grupy funkcjonalne, które można ładować elektrycznie. Jak? Przez tworzenie lub pęknięcie wiązań kowalencyjnych, bardzo podobny do przykładu cząsteczki NH3.
Może ci służyć: żelazo (element): charakterystyka, struktura chemiczna, używaNiektóre organiczne aniony to:
-Ch3Gruchać-, octan.
-HCOO-, Format.
-C2ALBO42-, Szczawian.
-RCOO-, Karboksylan.
-Ch3Conh-, Amidato.
-Ro-, Alcoxide.
-R3C-, Carbanion.
-Ch3ALBO-, Metlexide.
Poliatomiczny
Oksoaniony są również anionami poliatomicznymi, to znaczy składają się z więcej niż jednego atomu. To samo dotyczy anionów organicznych. Jednak poliatomiczny nie wprowadza żadnej z poprzednich klasyfikacji. Niektórzy z nich są:
-Cn-, cyjanek (ma potrójne łącze, C≡N).
-Ocn-, Cyjanat.
-Scn-, Tiocianato.
-NH2-, Amiduro.
-Oh-, hydroksyl, wodorotlenek lub oksydrillo.
-ALBO2-, nadtlenek.
-ALBO22-, nadtlenek.
Molekularne lub złożone
W anionach organicznych wspomniano niektóre negatywnie obciążone grupy funkcjonalne. Grupy te mogą być częścią dużej cząsteczki, a zatem anion może być solidnym związkiem i wieloma linkami. Najprostszym tego typu anionów jest hipotetyczna cząsteczka H2-.
Wśród innych przykładów tych anionów są polisulfuros, sN2-, które składają się z łańcuchów z wieloma łączami S-S. Podobnie można policzyć związki koordynacyjne metalu o obciążeniu ujemnym, takie jak [COCL4(NH3)2]- i [Cucl4]2-.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2019). Anion. Odzyskane z: jest.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (21 marca 2019 r.). Wspólna tabela anionów i lista formuł. Odzyskane z: Thoughtco.com
- Fundacja CK-12. (29 czerwca 2016 r.). Formacja anionowa. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Francis e. (2002). Aniony. Clackamas Community College. Źródło: DL.Clackamas.Edu
- Amerykańskie społeczeństwo fizyczne. (3 listopada 2011). Streszczenie: najprostszy anion molekularny. Odzyskane z: fizyka.APS.org
- « Fernando del Paso Biografia, styl, prace i frazy
- Struktura anisolu, właściwości, nomenklatura, ryzyko i zastosowania »

