Struktura anisolu, właściwości, nomenklatura, ryzyko i zastosowania
- 926
- 230
- Pani Gilbert Stolarczyk
On anisol lub metoksybenzen Jest to związek organiczny, który składa się z aromatycznego eteru, którego wzór chemiczny wynosi C6H5Och3. Jego stan fizyczny to bezbarwny płyn, który może prezentować żółte zabarwienie. Jest to łatwo rozpoznawane przez charakterystyczny zapach anyżu.
Jest to zatem lotny związek i niezbyt wysokie siły spójności; zwykłe cechy w eterach lekkich, które są przechowywane w małych uszczelnionych pojemnikach. W szczególności Anisol jest najprostszym z eteru alkilowego aury; to znaczy te z komponentem aromatycznym (AR) i innym alkil (R), AR-O-R.
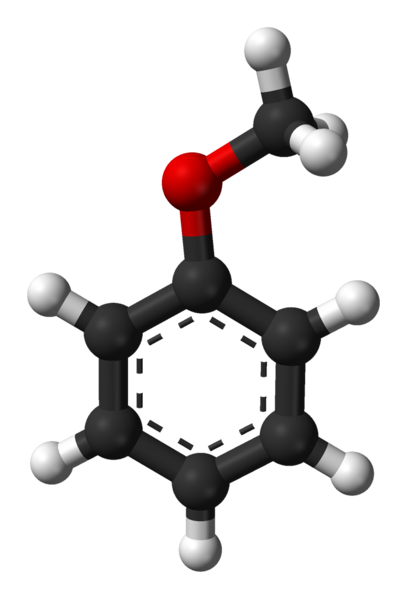
 Cząsteczka anisolu. Źródło: Ben Mills przez Wikipedia.
Cząsteczka anisolu. Źródło: Ben Mills przez Wikipedia. Grupa c6H5- przychodzi, aby oznaczyć AR i -ch3 A r, w ten sposób c6H5-O-ch3. Pierścień aromatyczny i obecność -ch3 Jako grupa podstawnikowa zwana metoxi, anisol daje nukleofilność lepszą niż benzen i nitrobenzen. Dlatego służy jako cząsteczka pośrednia do syntezy związków z aktywnością farmakologiczną.
Jego charakterystyczny zapach anyżu został wykorzystany do dodania anizolu do produktów kosmetycznych i higienicznych, które wymagają przyjemnego zapachu.
[TOC]
Struktura anisolu
Na górnym obrazie struktura molekularna anisolu jest pokazana za pomocą modelu sfery i słupków. Pierścień aromatyczny jest doceniany, którego węgle są specie2 i dlatego jest płaski, jak arkusz sześciokąta; I jest z nim powiązana, jest grupa metoxi, której węglem jest sp3, a jego hydrogeny są powyżej lub poniżej płaszczyzny pierścieniowej.
Znaczenie grupy -och3 W strukturze wykracza poza łamanie z płaską geometrią cząsteczki: daje jej polarność, a zatem cząsteczka apolarna benzenu nabiera trwałego momentu dipolowego.
Moment dipolarny
Ten moment dipolowy wynika z atomu tlenu, który przyciąga elektroniczną gęstość zarówno pierścienia aromatycznego, jak i metylowego. Dzięki temu cząsteczki Anisolu mogą oddziaływać na pół-dipolo siły; Chociaż brakuje mu możliwości tworzenia mostów wodorowych, ponieważ jest to eter (ROR nie ma połączenia tlenu).
Może ci służyć: chlorek sodu (NaCl)Jego wysoka temperatura wrzenia (154ºC), eksperymentalnie certyfikuje silne interakcje międzycząsteczkowe, które regulują jej płynny. Podobnie, londyńskie siły dyspersji są obecne, zależne od masy cząsteczkowej i interakcji π -π między samymi pierścieniami.
Kryształy
Struktura Anisola jednak nie pozwala mu.F = -37ºC). Może to również wynikać z faktu, że gdy odległości międzycząsteczkowe są zmniejszone, odpychanie elektrostatyczne między sąsiednimi pierścieniami aromatycznymi są bardzo silne.
Dlatego, i zgodnie z badaniami krystalograficznymi cząsteczki anisolu w kryształach w temperaturze -173ºC nie mogą być zamówione w taki sposób, aby ich pierścienie były skierowane; Oznacza to, że jego aromatyczne centra nie są ze sobą zgodne, ale grupa -ch3 Jest w górę lub pod sąsiednim pierścieniem.
Nieruchomości
Wygląd fizyczny
Bezbarwny płyn, ale może to przedstawić łagodne tony słomy.
Zapach
Pachnie lekko podobnie do nasion anyżu.
Smak
Słodki; Jest jednak umiarkowanie toksyczny, więc ten test jest niebezpieczny.
Masa cząsteczkowa
108 140 g/mol.
Gęstość
0,995 g/ml.
Gęstość pary
3,72 (w relacji powietrznej = 1).
Temperatura topnienia
-37ºC.
Punkt wrzenia
154ºC.
punkt zapłonu
125ºC (otwarty kubek).
Temperatura samo -kierunkowego
475ºC.
Breja
0,778 CP w 30ºC.
Napięcie powierzchniowe
34,15 din/cm A 30ºC.
Indica refrakcji
15179 do 20ºC.
Rozpuszczalność
Słabo rozpuszczalne w wodzie (około 1 mg/ml). W innych rozpuszczalnikach, takich jak aceton, etery i alkohole, jest jednak bardzo rozpuszczalny.
Nukleofilność
Aromatyczny pierścień Anisola jest bogaty w elektrony. Wynika to z faktu, że tlen, mimo że jest atomem bardzo elektroongeneracyjnym, przyczynia się do elektronów ich chmury π, aby zdemocniać je przez pierścień w wielu strukturach rezonansowych. W związku z tym więcej elektronów przejeżdża układ aromatyczny, a zatem zwiększa jego nukleofilność.
Może ci serwować: alkohol z kamforyki: struktura, formuła, właściwości i zastosowaniaEksperymentalnie wykazano wzrost nukleofilowości przez porównanie jej reaktywności w obliczu aromatycznych podstawień elektrofilicznych, z recepcją benzenu. Zatem świadek jest niezwykły efekt grupy -och3 W sprawie właściwości chemicznych związku.
Należy również zauważyć, że podstawienia elektrofilowe występują w sąsiednich pozycjach (-orto) i przeciwnych (-For) z grupą metoxi; to znaczy, że jest to reżyser orto-for.
Reaktywność
Aromatyczna nukleofilność pierścienia Anisola już pozwala spojrzeć na jego reaktywność. Zastąpienia mogą nastąpić albo na pierścieniu (faworyzowany przez jego nukleofilność) lub w tej samej grupie Metaxi; W tym ostatnim łącze O-CH3 Aby wymienić -ch3 przez inną grupę alquiliczną: O-Alquilación.
Dlatego w procesie alkilowania anisol może zaakceptować grupę R (fragment innej cząsteczki) zastępujący H jego pierścienia (C-Living) lub zastąpienie CH3 Z twojej grupy metoksi. Poniższy obraz ilustruje to, co właśnie powiedziano:
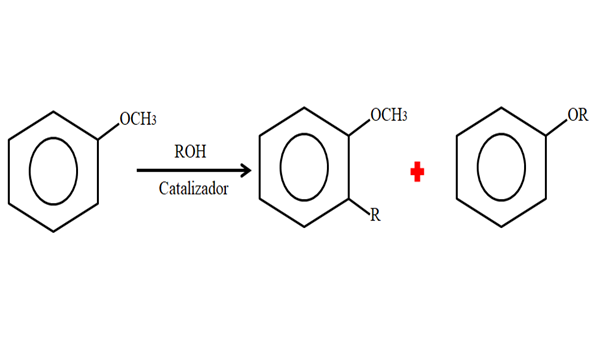 Alkilacja anisol. Źródło: Gabriel Bolívar.
Alkilacja anisol. Źródło: Gabriel Bolívar. Na obrazie grupa R znajduje się w pozycji -orto, ale może być również w pozycji -for, przeciwieństwie do -ch3. Kiedy zdarzy się O -Alquilación, uzyskano nowy eter z inną grupą.
Nomenklatura
Nazwa „Anisol” jest najbardziej znaną i akceptowaną, najprawdopodobniej pochodzącej z zapachu podobnego do anyżu. Jednak nazwa „metoksibenzen” jest dość specyficzna, ponieważ ustala struktura i tożsamość tego aromatycznego eteru; To jest nazwa rządzona przez systematyczną nomenklaturę.
Kolejną mniej używaną nazwą, ale równie ważną, jest „eter metylowy”, który jest regulowany przez tradycyjną nomenklaturę. Jest to być może najbardziej specyficzna nazwa wszystkich, ponieważ wskazuje bezpośrednio, które są dwie części strukturalne eteru: foenylo-o-metylo, c6H5-O-ch3.
Ryzyko
Badania medyczne nie były jeszcze w stanie wykazać możliwego śmiertelnego wpływu anisolu na ciało w niskich dawkach. Jednak, podobnie jak prawie wszystkie substancje chemiczne, wywołuje podrażnienia, gdy zbyt czas jest odsłonięty i w umiarkowanych stężeniach do skóry, gardła, płuc i oczu.
Może ci służyć: prawo amagat: wyjaśnienie, przykłady, ćwiczeniaPonadto, ze względu na nukleofilność jego pierścienia, jego część jest metabolizowana i dlatego jest biodegradowalny. W rzeczywistości, w wyniku tej właściwości, symulacje wykazały, że nie koncentruje się na ekosystemach wodnych, ponieważ jego organizmy najpierw ją degradują; I dlatego rzeki, jeziora lub morza mogą gromadzić anisol.
W glebach, biorąc pod uwagę jego zmienność, szybko odparowuje i jest przeciągnięty przez prądy powietrzne; Zatem masy warzywne ani plantacje nie wpływają znacznie.
Z drugiej strony, atmosferycznie reaguje z wolnymi rodnikami, a zatem nie reprezentuje ryzyka zanieczyszczenia powietrza, które oddychamy.
Aplikacje
Synteza organiczna
Z anisolu inne pochodne można uzyskać przez aromatyczne podstawienie elektrofilowe. Umożliwia to zastosowanie jako pośrednik do syntezy leków, pestycydów i rozpuszczalników, które mają na celu dodanie swoich cech. Drogi syntetyczne mogą składać się głównie z.
Zapachy
Oprócz zastosowania w syntezie organicznej, może być stosowany bezpośrednio jako addytywny dla kremów, maści i perfum, zawierający zapachy zapachowe do takich produktów.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. DO. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- National Center for Biotechnology Information. (2019). ANISOLE. Baza danych Pubchem, CID = 7519. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2019). ANISOLE. Źródło: w:.Wikipedia.org
- Pereira, Cynthia C. M., De la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Ciekłe fazelowanie anizolu i fenolu katalizowane przez fosforan niobum. Journal of the Brazilian Chemical Society, 21 (2), 367-370. Dx.doi.Org/10.1590/S0103-50532010000200025
- Seidel r. W. i Goddard R. (2015). Anizol przy 100 K: Pierwsza determinacja struktury krystalicznej. Crystallogr C struct chem Act. Sierpień; 71 (Pt 8): 664-6. Doi: 10.1107/S2053229615012553
- Preparat chemiczny. (2018). Metoksybenzen. Odzyskane z: preparat quimica.com

