Trening kation, różnice z anionem i przykłady

- 2517
- 131
- Gabriela Łuczak
A kation Jest to gatunek chemiczny, który ma ładunek dodatni. Dwa rodzaje istniejących jonów dotyczą anionu. Jego obciążenie jest iloczynem niedoboru elektronów w atomie, co powoduje, że protony rdzeniowe wykorzystają większą atrakcję. Dla każdego elektronu, który traci neutralny atom, obciążenie dodatnie jest zwiększone w jednostce.
Jeśli atom straci elektron, a zatem liczba protonów jest większa niż jeden, wówczas jego dodatnie obciążenie wyniesie +1; Jeśli stracisz dwa elektrony, obciążenie wyniesie +2 i tak dalej. Kiedy kation ma obciążenie +1, mówi się, że jest monowalentny; Z drugiej strony, jeśli wspomniane obciążenie jest większe niż +1, mówi się, że kation jest wszechstronny.
 Hydronio, jeden z najprostszych kationów. Źródło: Gabriel Bolívar.
Hydronio, jeden z najprostszych kationów. Źródło: Gabriel Bolívar. Na górnym obrazie pokazano kation h3ALBO+, Nazywany hydronio ion. Jak widać, ledwo ma obciążenie +1, zgodnie z monowalentnym kationem.
Katory są ważnymi gatunkami, ponieważ wywierają siłę elektrostatyczną ze swoim środowiskiem i cząsteczkami wokół. Mają wysoką interakcję z wodą, płynem, która nawilża i transportuje je w mokrych glebach, a następnie docierają do korzeni roślin i są wykorzystywane do ich funkcji fizjologicznych.
[TOC]
Jak powstaje kation?
Wspomniano, że gdy atom straci elektron, jego największa liczba protonów, w stosunku do elektronów, wywiera siłę przyciągania, która przekłada się na obciążenie dodatnie. Ale jak może wystąpić utrata elektronów? Odpowiedź zależy od transformacji, która wystąpiła w reakcjach chemicznych.
Należy zauważyć, że obecność atomu z dodatnim obciążeniem niekoniecznie oznacza tworzenie kationu. Aby można to uznać za takie, nie powinien być atomu z ujemnym obciążeniem formalnym, które zneutralizują. W przeciwnym razie byłoby przyciąganie i odpychanie w tym samym związku i byłyby neutralne.
Może ci służyć: siarczan wapnia (przypadek 4): struktura chemiczna, właściwości, zastosowaniaFormalne opłaty i więcej linków
Atomy elektroungatywne przyciągają do nich elektrony ich kowalencyjnych wiązań. Chociaż elektrony są dzielone jednakowo, istnieje punkt, w którym częściowo będą mieli mniej elektronów niż w ich podstawowej konfiguracji; To jest ich wolne atomy bez powiązania z innymi elementami.
Następnie te atomy elektroungatywne zaczną doświadczać niedoboru elektronów, a wraz z nim protony ich jąder wywierają siłę o większym przyciąganiu; Rodzi się dodatnie obciążenie formalne. Jeśli istnieje jedynie dodatnie obciążenie formalne, związek przejawia globalne dodatnie obciążenie jonowe; Tak narodził się kation.
Atom tlenu kationu h3ALBO+ Jest to wierny przykład powyższego. Mając trzy wiązania O-H, jedno więcej niż w cząsteczce wody (H-O-H), doświadcza utraty elektronu w odniesieniu do stanu podstawowego. Obliczenia obciążeń formalnych pozwalają na ustalenie, kiedy to się stanie.
Jeśli na chwilę przyjmuje się powstawanie innego O-H, zostanie uzyskane kation benzyny4ALBO2+. Należy zauważyć, że obciążenie dwuwartościowe na kationie jest zapisywane w następujący sposób: liczba następuje po symbolu „+”; W ten sam sposób aniony są kontynuowane.
Utlenianie
Metale to formatory kationów par excellence. Jednak nie każdy może tworzyć kowalencyjne obligacje (lub przynajmniej czysto kowalencyjne). Zamiast tego tracą elektrony w celu ustalenia wiązań jonowych: dodatnie obciążenie przyciąga ujemne, zjednoczone siły fizyczne.
Dlatego metale tracą elektrony, aby przejść z M do MN+, Gdzie N Zazwyczaj jest to równe liczbie twojej grupy w stole okresowym; Chociaż N Możesz wziąć kilka całości, które występują szczególnie w przypadku metali przejściowych. Ta utrata elektronów jest przeprowadzana w rodzaju reakcji chemicznej zwanej utlenianiem.
Może ci służyć: trzeciorzędowy alkohol: struktura, właściwości, przykładyMetale utleniają się, tracą elektron, liczba protonów ich atomów przekracza elektrony, a w konsekwencji wykazują dodatnie obciążenie. Aby utlenić, musi istnieć środek utleniający, który zmniejsza lub zyskuje elektrony utracone przez metale. Tlen jest najbardziej znanym środkiem utleniającym ze wszystkich.
Różnice z anionem
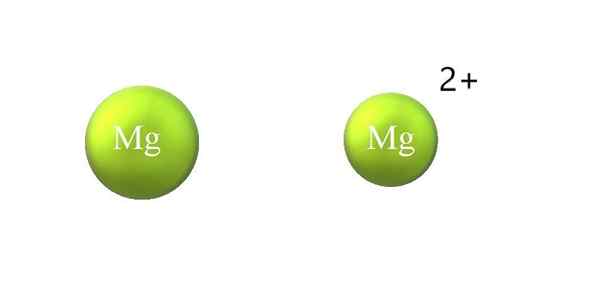 Skurcz promienia atomowego w kationie. Źródło: Gabriel Bolívar.
Skurcz promienia atomowego w kationie. Źródło: Gabriel Bolívar. Poniżej znajdują się różnice między kationem a anionem:
-Ogólny kation jest mniejszy niż anion. Górny obraz pokazuje, w jaki sposób promień atomowy Mg jest zmniejszony poprzez utratę dwóch elektronów i stając się kationą mg2+; Przeciwieństwo występuje z anionami: stają się bardziej nieporęczne.
-Ma więcej protonów niż elektronów, podczas gdy anion ma więcej elektronów niż protony.
-Będąc mniejszą, jego gęstość obciążenia jest wyższa, a zatem ma większą moc polaryzacyjną; to znaczy deformuje elektroniczne chmury sąsiednich atomów.
-Kation porusza się w tym samym kierunku, co zastosowane pole elektryczne, podczas gdy anion robi to w przeciwnym kierunku.
Przykłady najczęstszych kationów
Monoatomic
Katory monoatomiczne pochodzą głównie z metali (z wyjątkiem niektórych wyjątków, takich jak H+). Reszty niezwykle rzadko jest rozważyć kation pochodzący z elementu niemetalicznego.
Okaże się, że wiele z nich jest di lub wszechstronne i że wielkości ich obciążeń zgadzają się z liczbą ich grup w stole okresowym.
Może ci służyć: rybulosa-1,5-bifosforan (RUBP): Charakterystyka, karboliksacja-Li+
-Na+
-K+
-RB+
-Cs+
-Fr+
-Ag+
Wszystkie mają wspólne obciążenie „1+”, które jest napisane bez umieszczenia liczby, a także pochodzi z grupy 1: metali alkalicznych. Poza tym istnieje kation AG+, Jeden z najczęstszych metali przejściowych.
-Być2+
-Mg2+
-AC2+
-Pan2+
-BA2+
-Ra2+
Te dwuwartościowe kationów pochodzą z ich odpowiednich metali należących do metali grupy 2: alkalineriorowe.
-Do3+
-Ga3+
-W3+
-Tl3+
-NH3+
Trójwalentne kationy grupy Boro.
Do tej pory przykłady scharakteryzowano za pomocą pojedynczej wartościowości lub obciążenia. Inne kationy wykazują więcej niż jeden stan wartościowości lub pozytywnego utleniania:
-Sn2+
-Sn4+ (cyna)
-Współ2+
-Współ3+ (kobalt)
-Au+
-Au3+ (złoto)
-Wiara2+
-Wiara3+ (żelazo)
A inne metale, takie jak mangan, mogą nadal mieć o wiele więcej wartościowości:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Im większe obciążenie, mniejsze i polaryzacja będzie kation.
Poliatomiczny
Nie wchodząc w chemię organiczną, istnieją kationy nieorganiczne i polilamiczne, które są bardzo powszechne w życiu codziennym; Jak na przykład:
-H3ALBO+ (Hydronio, już wspomniane).
-NH4+ (amon).
-NIE2+ (Nitronio, obecny w procesach nitracyjnych).
-Ph4+ (Fosfonium).
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (5 maja 2019 r.). Definicja i przykład kation. Odzyskane z: Thoughtco.com
- Wyman Elizabeth. (2019). Kation: definicja i przykład. Badanie. Odzyskane z: Study.com
- Manekiny. (2019). Pozytywne i negatywne INS: kationy i aniony. Odzyskane z: manekinów.com
- Wikipedia. (2019). Kation. Odzyskane z: jest.Wikipedia.org
- « Struktura anisolu, właściwości, nomenklatura, ryzyko i zastosowania
- Pochodzenie archeolityczne, cechy, klimat, flora i fauna »

