Alkynes
- 2268
- 421
- Eugenia Czapla
 Struktura alvento z potrójnym łączem
Struktura alvento z potrójnym łączem Co to są alkiny?
Alkynes Są to węglowodory lub związki organiczne, które w ich strukturach występują potrójne połączenie między dwoma węglowodanami. Ten potrójny łącze (≡) jest uważany za grupę funkcjonalną podczas reprezentowania aktywnego miejsca cząsteczki, a zatem jest odpowiedzialny za ich reaktywność.
Chociaż alkyny nie różnią się zbytnio od alko lub alkenów, wykazują większą kwasowość i polaryzację ze względu na charakter ich powiązań. Dokładnym terminem opisującym tę niewielką różnicę jest to, co jest znane jako nienasycenie.
Alkan są nasycone węglowodory, podczas gdy alkiny są najbardziej nienasycone w odniesieniu do oryginalnej struktury. Co to znaczy? Że alkan h3C-ch3 (etan) może być dehydroge do H2C = CH2 (etene), a następnie HC≡CH (Etino lub lepiej znany jako acetylen).
Zwróć uwagę, w jaki sposób dodatkowe linki są tworzone między węgliami zmniejszają liczbę powiązanych z nimi hydrogenów. Węgiel, ze względu na jego charakterystykę elektroniczną, ma na celu utworzenie czterech prostych linków, więc im większa tendencja do reagowania (z wyjątkiem związków aromatycznych).
Z drugiej strony potrójne łącze jest znacznie silniejsze niż podwójne (=) lub proste (-) wiązanie, ale przy wysokim koszcie energii. Stąd większość węglowodorów (alkan i alkenów) może tworzyć potrójne wiązania w wysokich temperaturach.
W wyniku wysokich energii, po łamaniu, wydają się bardzo gorące. Przykład tego zjawiska można zobaczyć, gdy acetylen spala tlenem i stosuje się intensywne ciepło płomienia do spawania lub stopu metali.
Acetylen jest najprostszym i najbardziej małym alkinem ze wszystkich. Inne węglowodory można wyrazić z ich wzoru chemicznego, zastępując H grupami alliquilowymi (RC≡CR '). To samo dzieje się w świecie syntezy organicznej poprzez dużą liczbę reakcji.
Ten alkin występuje z reakcji tlenku wapnia wapienia i kółki, surowca, który zapewnia niezbędne węgle wewnątrz piekarnika elektrycznego:
CAO + 3C => CAC2 + WSPÓŁ
CAC2 Jest to węglik wapnia, związek nieorganiczny, który ostatecznie reaguje z wodą, tworząc acetylen:
CAC2 + 2h2O => ca (oh)2 + HC≡CH
Właściwości fizyczne i chemiczne alkin
Biegunowość
Triple Link odróżnia alkiny od alkanów i alkenów. Trzy typy węglowodorów są niepolarne, nierozpuszczalne w wodzie i bardzo słabe kwasy. Jednak elektrocjalność węgli z podwójnym i potrójnym wiązaniem jest większa niż w przypadku prostych węgli.
Zgodnie z tym, węgle sąsiadujące z wydajnością potrójnego wiązania do efektu indukcyjnego ujemnego obciążenia. Z tego powodu, gdzie są łącza C≡C lub C = C, będą większa gęstość elektroniczna niż w pozostałej części gazowanego szkieletu. W konsekwencji istnieje niewielki moment dipolowy, w którym cząsteczki oddziałują na siły dipola-dipolo.
Te interakcje są bardzo słabe, jeśli ich momenty dipolowe są porównywane z interpretacją cząsteczki wody lub alkoholu. Znajduje to odzwierciedlenie w ich właściwościach fizycznych: alkiny mają ogólnie wyższe punkty fuzji i wrzenia w porównaniu z ich mniej nienasyconymi węglowodorami.
Może ci służyć: 7 najważniejszych aplikacji biochemiiPodobnie, ze względu na ich niską polaryzację, są mniej nierozpuszczalne w wodzie, ale rozpuszczalne w apolarnych rozpuszczalnikach organicznych, takich jak benzen.
Kwasowość
Również ta elektrooniczność powoduje wodór HC≡CR jest bardziej kwaśny niż ktokolwiek obecny w innych węglowodorach. Dlatego alkiny są gatunkami bardziej kwaśnymi niż alkeny i znacznie więcej niż alkan. Jednak jego kwasowość pozostaje nikczemna w porównaniu do kwasów karboksylowych.
Ponieważ alkiny są bardzo słabymi kwasami, reagują tylko z bardzo silnymi zasadami, takimi jak sód po amiduro:
HC≡CR + NANH2 => HC≡CNA + NH3
Z tej reakcji uzyskuje się roztwór acetyluru sodu, surowiec do syntezy innych alkinów.
Reaktywność Alquinos
Reaktywność alkenów wyjaśniono dodaniem małych cząsteczek do ich potrójnego łącza, zmniejszając jego nienasycenie. Mogą to być cząsteczki wodoru, hallogendy wodorowe, woda lub halogeny.
Uwodornienie
Mała cząsteczka H2 Jest bardzo nieuchwytny i szybki, więc zwiększenie szans na dodanie do potrójnego ogniwa alkin.
Są to zwykle metale (PD, Pt, Rh lub Ni) drobno podzielone w celu zwiększenia powierzchni; I w ten sposób kontakt między wodorem a alquino:
RC≡CR ' + 2H2 => RCH2Ch2R '
W rezultacie wodór jest „kotwicą” do węgle łamiącej wiązanie i tak dalej, dopóki odpowiedni alkan, RCH2Ch2R '. To nie tylko nasyca początkowe węglowodór, ale także modyfikuje jego strukturę molekularną.
Dodanie halogenomorunów wodoru
Tutaj dodaje się cząsteczkę nieorganiczną HX, gdzie x może być dowolnym halogenami (F, Cl, Br lub I):
RC≡CR ' + hx => rch = cxr'
Uwodnienie
Hydratowanie alkin ma miejsce, gdy dodają cząsteczkę wody, tworząc aldehyd lub keton:
RC≡CR ' + H2O => rCH2Cor '
Jeśli r 'jest h, jest to aldehyd; Jeśli jest to czynsz, to jest to cetona. W reakcji związek znany jako enol (RCH = C (OH) R ') powstaje jako pośrednik.
To cierpi na konwersję postaci enolowej (C-OH) na keton (C = O) w równowadze zwanej tautomeryzacją.
Dodanie halogenów
W odniesieniu do dodatków cząsteczki dwuatomiczne halogenów mogą być również zakotwiczone w węgle (x x2= F2, Cl2, Br2 słyszałem2):
RC≡CR ' + 2x2 => Rcx2-Cx2R '
Acetylenowa alkilowanie
Z roztworu acetylowego sodu inne alkiny można przygotować za pomocą halogenku wynajmu:
HC≡CNA + Rx => HC≡CR + Nax
Na przykład, gdyby był to jodek metylu, wynikowy alkin byłby:
HC≡CNA + CH3I => HC≡CCH3 + Nax
HC≡CCH3 jest właściwym, znanym również jako Metylacetylen.
Struktura chemiczna alkin
 Struktura chemiczna Alquino
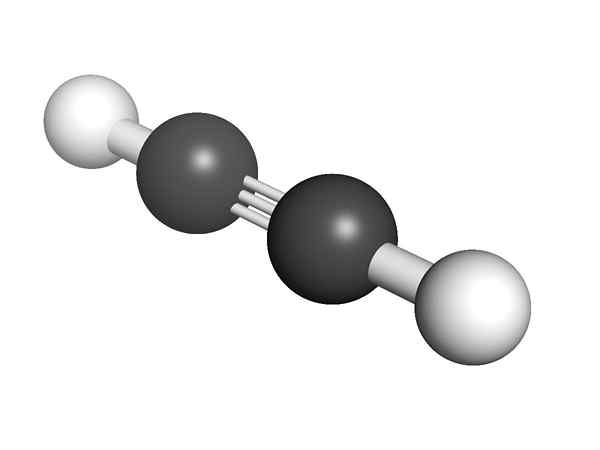
Struktura chemiczna Alquino Jaka jest struktura alkinów? Na górnym obrazie pokazano cząsteczkę acetylenu. Liniowa geometria łącza C≡C może być z niego jasna.
Dlatego tam, gdzie jest potrójne wiązanie, struktura cząsteczki musi być liniowa. To kolejna z godnych uwagi różnic między nimi a resztą węglowodorów.
Może ci służyć: cykopropan (C3H6)Alkan są zwykle reprezentowane jako zygzak, ponieważ mają hybrydyzację SP3 a ich linki są oddzielone 109º. W rzeczywistości są kowalencyjnie zjednoczonym łańcuchem tetrahedra. Podczas gdy alkeny są płaskie do hybrydyzacji SP2 z jego węgli, tworząc dokładniej płaszczyznę trygonalną z oddzielonymi ogniwami o 120º.
W alkinach hybrydyzacja orbitalna to SP, to znaczy mają 50% S i 50% P. Istnieją dwa hybrydowe orbitale SP, które są powiązane z atomami H w grupach acetylenowych lub alkinowych w alkinach.
Odległość zarówno H lub R wynosi 180º, oprócz faktu, że tylko w ten sposób orbitale czyste. Z tego powodu link -C≡C- jest liniowy. Widząc strukturę dowolnej cząsteczki, -C≡C - w tych obszarach, w których szkielet jest bardzo liniowy.
Odległość od linków i jałmów terminalowych
Węgle w potrójnym wiązaniu są w mniejszej odległości niż w podwójnym lub prostym ogniw. Innymi słowy, C≡C jest krótszy niż C = C i że C-C. W rezultacie łącze jest silniejsze, ponieważ dwa łącza π przyczyniają się do ustabilizowania prostego łącza σ.
Jeśli potrójna wiązanie znajduje się na końcu łańcucha, to jest końcowa alkin. Dlatego wzorem wspomnianego związku musi być HC≡CR, gdzie H zauważa koniec lub początek łańcucha.
Jeśli wręcz przeciwnie, jest to potrójne połączenie wewnętrzne, wzór jest RC≡CR ', gdzie r i r' są prawą i lewą stroną łańcucha.
Nomenklatura Alquinos
Jak wyznaczane są alkiny zgodnie z zasadami podyktowanymi przez IUPAC? W taki sam sposób, jak wyznaczono Alquenos i Alkeny. Aby to zrobić, sufiks -ano lub -eno dla sufiks -ino jest zmieniane.
Na przykład: HC≡CCH3 Jest to wyznaczone wskazówki, ponieważ ma trzy węgle, takie jak propan (Cho3Ch2Ch3). HC≡CCH2Ch3 Jest to 1-butino, który jest końcowym alkinem. Ale w przypadku Cho3C≡CCH3 To jest 2-butino, a w tym potrójne link nie jest terminal, ale wewnętrzny.
Ch3C≡CCH2Ch2(Ch3)2 Jest to 5-metylo-2-heksyna. Węglowodory zaczyna się od boku najbliżej potrójnego linku.
Innym rodzajem alkin są cykloalquiny. Dla nich wystarczy zastąpić sufiks -ano przez -ino odpowiedniego cykloalcanu. Zatem cyklopropan, który ma potrójne wiązanie, jest nazwany cyklopropiną (która nie istnieje).
Gdy są dwa potrójne linki, do nazwy prefiks jest dodawany-. Ma jako przykłady do HC≡C-C≡H, diacetylenu lub propadyny; I do HC≡C-C-C≡H, butadiino.
Alquinos używa
Acetylen lub etino
Najmniejsza z alkinów zagęszcza możliwą liczbę zastosowań tych węglowodorów. Od niego przez ALKS można zsyntetyzować inne związki organiczne. Przechodzi także reakcje oksydacyjne w celu uzyskania między innymi etanolu, kwasu octowego, kwasu akrylowego.
Może ci służyć: Wodorządek litowy: struktura, właściwości, uzyskiwanie, zastosowaniaInne z jego zastosowań polega na zapewnieniu źródła ciepła do podniecenia elektronów atomów; Bardziej specyficzne, E kationów metali w określaniu przez atomową emisję absorpcji, szeroko stosowana technika spektroskopowa.
Naturalne alkiny
Jedynymi istniejącymi metodami przygotowywania alkinów są nie tylko syntetyczne lub z zastosowaniem ciepła przy braku tlenu, ale także biologiczne.
W tych enzymach nazywanych acetylelese, które mogą odmówić podwójnej więzi. Dzięki temu osiągnięto wiele naturalnych źródeł alkinów.
Następnie źródła te można ekstrahować trucizny, antidotum, leki lub jakikolwiek inny związek, który zapewnia wszelkie korzyści; Zwłaszcza, gdy dotyczy zdrowia. Alternatywy są wiele przy modyfikowaniu ich oryginalnych struktur i posiadania ich jako wsparcia dla nowych alkin.
Przykłady alkinów
Jak dotąd wymieniono wiele przykładów alkin. Jednak niektóre pochodzą z bardzo specyficznych źródeł lub mają określone struktury molekularne: są to poliacetyle.
Oznacza to, że może być więcej niż potrójne ogniwo, które jest częścią bardzo dużej struktury, a nie tylko prostego łańcucha gazowanego.
Kwas tarirowy
 Struktura kwasu tarynowego
Struktura kwasu tarynowego Kwas tarirowy pochodzi z rośliny położonej w Gwatemali o nazwie Picramnia tariri. Jest specjalnie ekstrahowany z oleju z nasion.
W swojej strukturze molekularnej można zaobserwować pojedynczy potrójne połączenie, które oddzielają nie apolowy ogon od głowy polarnej; Dlatego można to uznać za cząsteczkę amfipatyczną.
Histrionikotoksyna
 Struktura histrionikotoksyny
Struktura histrionikotoksyny Histrionikotoksyna jest trucizną segregowaną przez skórę mieszkańców Kolumbii, Brazylii i innych krajów Ameryki Łacińskiej. Ma dwa potrójne sprzężone linki z podwójną wiązaniem. Oba są zaciskami i są oddzielone sześciokątnym pierścieniem i cykliczną aminą.
Cicutoksyna
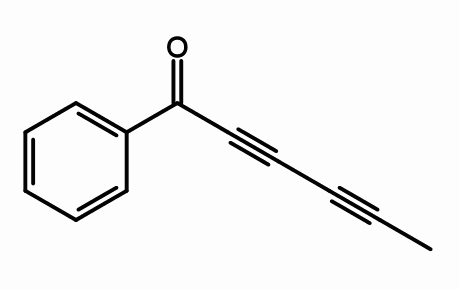 Struktura cykutoksyny. Przez giorgiogp2 [cc by-sa 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0) lub gfdl (http: // www.gnu antylopa.Org/copyleft/fdl.html)], z Wikimedia Commons
Struktura cykutoksyny. Przez giorgiogp2 [cc by-sa 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0) lub gfdl (http: // www.gnu antylopa.Org/copyleft/fdl.html)], z Wikimedia Commons Z struktury molekularnej cykutoksyny, gdzie są potrójne łącza? Jeśli podwójne wiązania są płaskie, jak widać są dobrze, a proste ogniwa to tetrahedrały, jak na końcach potrójne są liniowe i są na zboczu (\).
Ten związek składa się z neurotoksyny występującej głównie w wodnej roślinie leczniczej.
Capilina
 Struktura kapiliny. Autor: Klever [CC0], z Wikimedia Commons
Struktura kapiliny. Autor: Klever [CC0], z Wikimedia Commons Jest to alkin obecny w olejku eterycznym z roślin Artemis, który jest stosowany jako środek przeciwgrzybiczy. Można zaobserwować dwa potrójne linki, bardziej poprawnie sprzężone.
Co to znaczy? Że potrójne wiązania rezonują wzdłuż całego łańcucha węglowego i obejmuje, że podwójne wiązanie C = O jest otwarte na C-O-.
Pargilin
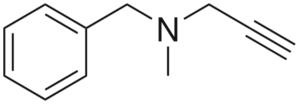 Struktura pargiliny
Struktura pargiliny Jest to alty z działaniem przeciwnadciśnieniowym. Analiza jej struktury w częściach to: grupa benchilo po lewej, trzeciorzędowa amina pośrodku i prawe; to znaczy końcowa grupa nieruchomości.
Bibliografia
- Francis a. Szylkret. Chemia organiczna. Kwasy karboksylowe. (Szósta edycja., Strona 368-397). MC Graw Hill.
- Brennan, John. (10 marca 2018 r.). Przykład alkinów. Naukowe. Zaczerpnięte z: naukowca.com
- Byju's. (2018). Potrójna więź w Alkynes. Zaczerpnięte z: Byjus.com
- Encyklopedia przykładów (2017). Alkynes. Odzyskane z: przykłady.współ
- Kevin a. Boudreaux. Alkynes. Zaczerpnięte z: Angelo.Edu
- Robert c. Neuman, jr. Alkeny i Alkynes. [PDF]. Zaczerpnięte z: chem.UCR.Edu

