Charakterystyka, struktura, funkcje Alfa Amilasa
- 4756
- 217
- Estera Wojtkowiak
Alfa Amilasa (α-amylaza) jest enzymem amilolitycznym grupy Endo Amilasas, która jest odpowiedzialna za hydrolizę wiązań α-1,4 między resztami glukozy, które tworzą różne rodzaje węglowodanów w naturze.
Systematycznie znany jako systematycznie znany jako α-1,4-glukan. Na przykład u ludzi amylazy obecne w ślinie i wydzielane przez trzustkę mają typ α-amylaz.
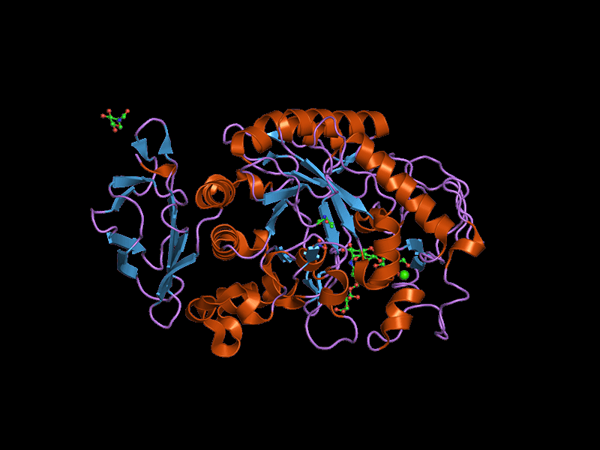
 C-końcowa struktura domeny Alfa Amilasa Animal (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [Public Domena] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons)
C-końcowa struktura domeny Alfa Amilasa Animal (Źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [Public Domena] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons) Kuhn, w 1925 r., Był pierwszym, który zdobędzie termin „α-amylaza” w oparciu o fakt, że produkty hydrolizy, które katalizują te enzymy, mają konfigurację α. Później, w 1968 r. Stwierdzono, że one najlepiej działają na podłożach konfiguracji strukturalnej liniowej i nieuprzewanej.
Podobnie jak inne enzymy amilolityczne, α-amylaza jest odpowiedzialna za hydrolizę skrobi i innych powiązanych cząsteczek, takich jak glikogen, wytwarzający mniejsze polimery złożone z powtarzanych jednostek glukozy.
Oprócz funkcji fizjologicznych, jakie ten enzym występuje u zwierząt, roślin i mikroorganizmów, które to wyrażają, α-amylaza, wraz z innymi klasami istniejących amylazy, reprezentują 25% enzymów stosowanych do celów przemysłowych i biotechnologicznych obecny rynek obecny.
Wiele gatunków grzybów i bakterii jest głównym źródłem uzyskiwania α-amylazy, które są częściej stosowane w eksperymentach przemyśle i naukowych. Wynika to głównie z jego wszechstronności, łatwego uzyskania, prostego zarządzania i niskich kosztów związanych z jego produkcją.
[TOC]
Charakterystyka
Α-amylazy znajdujące się w naturze mogą mieć optymalne zakresy pH o bardzo innym pH dla jego działania; Na przykład optymalne dla zwierząt α-amylazy i rośliny wynosi między 5.5 i 8.0 jednostek pH, ale niektóre bakterie i grzyby mają więcej enzymów alkalicznych i więcej kwaśnych.
Może ci służyć: filogenezaEnzymy obecne w ślinie i trzustce ssakowej działają lepiej przy pH blisko 7 (neutralne), wymagają one jonów chlorkowych, aby osiągnąć maksymalną aktywność enzymatyczną i są w stanie przyłączyć się do zbieżnych jonów wapnia.
Zarówno zwierzęta, enzymy ślinowe i trzustkowe są wytwarzane w organizmach przez niezależne mechanizmy obejmujące określone komórki i gruczoły i prawdopodobnie nie są związane z enzymami obecnymi w krążeniowym potoku i innych jamach ciała.
Zarówno pH, jak i optymalna temperatura funkcjonowania tych enzymów zależy w dużej mierze od fizjologii rozważanej organizmu, ponieważ istnieją ekstremofilne mikroorganizmy, które rosną w bardzo szczególnych warunkach w odniesieniu do tych i wielu innych parametrów.
Wreszcie, jeśli chodzi o regulację jej aktywności, charakterystyczne dzielone między enzymami grupy α-amylazy polega na tym, że one, podobnie jak inne amylazy, mogą być hamowane przez jony metali ciężkich, takie jak rtęć, miedź, srebro i ołów.
Struktura
Α-amylaza jest enzymem wielorięśniowym, który u zwierząt i roślin ma przybliżoną masę cząsteczkową 50 kDa, a różni autorzy zgadzają się, że enzymy należące do tej rodziny glikohydrolizy są enzymami z więcej niż dziesięć domen strukturalnych.
Domena centralna lub domena katalityczna jest bardzo zachowana i jest znana jako domena A, która składa się z symetrycznego fałdu 8 β-spłaty arkuszy ułożonych w postaci „lufy”, które są otoczone 8 halami alfa, dzięki czemu można również znaleźć w literaturze, jak lufa typu (β/α) 8 lub „Tim”.
Należy zauważyć, że na końcu C-końcowym arkuszy β domeny A są zachowanymi odpadami aminokwasowymi, które są zaangażowane w katalizę i w połączeniu substratu i że domena ta znajduje się w regionie N-końcowym w obszarze N-końcowym białko.
Może ci służyć: fauna i flora morza peruwiańskiegoKolejną z najczęściej badanych domen tych enzymów jest tak zwany ding B, który wyróżnia się między blaszką β-Peeled a śmigłem alfa numer 3 domeny a. Odgrywa to fundamentalną rolę w Związku podłoża i wapniu Dyspolitalne.
Dodatkowe domeny zostały opisane dla enzymów α-amylasy, takich jak domeny C, D, F, G, H i I, które znajdują się z przodu lub z tyłu domeny A i których funkcje nie są dokładnie znane i zależą od organizmu, który jest badany.
α-amylaz mikroorganizmów
Zależy masa cząsteczkowa α-amylaz, a także inne cechy biochemiczne i strukturalne, od badanego organizmu. Zatem α-amylazy wielu grzybów i bakterii mają wagi tak niskie jak 10 kDa i nawet 210 kDa.
Wysoka masa cząsteczkowa niektórych z tych enzymów drobnoustrojów jest często związana z obecnością glikozylacji, chociaż glikozylacja białka w bakteriach jest dość rzadka.
Funkcje
U zwierząt α-amylaz są odpowiedzialne za pierwsze etapy metabolizmu skrobi i glikogenu, ponieważ są odpowiedzialne za hydrolizę mniejszych fragmentów. Narządy układu przewodu pokarmowego odpowiedzialne za ich produkcję u ssaków to trzustka i gruczoły ślinowe.
Oprócz jego oczywistej funkcji metabolicznej, wytwarzanie α-amylaz wytwarzanych przez gruczoły ślinowe wielu ssaków, aktywowane przez działanie noradrenaliny, jest uważane przez wielu autorów za ważny marker stresu „psychobiologicznego” w stresie w ośrodkowym układzie nerwowym.
Ma również funkcje wtórne w zdrowiu jamy ustnej, ponieważ jego aktywność działa w eliminacji bakterii jamy ustnej i zapobieganiu jej przyczepności do powierzchni doustnych.
Może ci służyć: specjacja sympatryczna: koncepcja, cechy i przykładyGłówna funkcja w roślinach
W roślinach α-amylaz odgrywa podstawową rolę w kiełkowaniu nasion, ponieważ są to enzymy, które hydrolizują skrobię obecną w bielku, który odżywia zarodek w środku, proces zasadniczo kontrolowany przez gibberelinę, fitormon.
Zastosowania przemysłowe
Enzymy należące do rodziny α-amylazy mają wiele zastosowań w wielu różnych kontekstach: przemysłowe, naukowe i biotechnologiczne itp.
W dużych branżach przetwarzania skrobi α-amylazy są popularnie stosowane do produkcji glukozy i fruktozy, a także do produkcji chleba o ulepszonych teksturach i większej lojalnej zdolności.
W dziedzinie biotechnologicznej istnieje duże zainteresowanie w zakresie poprawy enzymów stosowanych komercyjnie, aby poprawić ich stabilność i wydajność w różnych warunkach.
Bibliografia
- Aiyer, s. 1. V. (2005). Amylazy i ich zastosowania. African Journal of Biotechnology, 4(13), 1525-1529.
- Bernfeld, s. 1. (1960). Amylazy, A i B. W Enzymy metabolizmu węglowodanów (Tom. I, pp. 149-158).
- Granger, d. DO., Kivighan, k. T., Ich., Gordis, e. B., & Stadnin, l. R. (2007). A-andlaze saliwary w badaniach biobehawioralnych. Najnowsze osiągnięcia i aplikacje. Ann. N.I. Acade. Sci., 1098, 122-144.
- Monteiro, s. 1., & Oliveira, p. (2010). Zastosowanie mikrobiologicznej a-ilazy w branży- przegląd. Brazylijski Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). Przegląd rodziny mikrobiologicznej α-kochanej. African Journal of Biotechnology, 2(12), 645-648.
- Sól, w., & Shenker, s. (1976). Amylaza- jego znaczenie kliniczne: przegląd literatury. Medycyna, 55(4), 269-289.
- Svensson, ur., & MacGregor i. DO. (2001). Związek sekwencji i struktury ze swoistością w rodzinie enzymów A-amylaza. Biochimica et biophysica acta, 1546, 1-20.
- Thoma, J. DO., Spradlin, J. I., & Dygert, s. (1925). Amylazy roślinne i zwierzęce. Ann. Chem., 1, 115-189.
- « Struktura reniny, produkcja, wydzielanie, funkcje
- Urie Bronfenbrenner Biografia, model ekologiczny i wkład »

