Fundacja agaru XLD, przygotowanie i zastosowania
- 5027
- 1418
- Maksymilian Kępa
On XLD Agar o Acho xilosa Desoksyk lizyny jest selektywną i różnicową hodowlą stałą dla izolacji enteropatogennej. Taylor zaprojektował formułę agaru XL (ksyloza, lizyna) w celu poprawy izolacji rodzaju Shigella.
Zauważył, że ten gatunek był zahamowany w większości mediów przeznaczonych do izolacji enteropatogenu. Następnie dodano go deksykolan sodu, tiosiarczanu sodu i cytrynianu amonicznego żelaza, aby zwiększyć jego selektywność. Ta formuła okazała się przydatna zarówno dla Shigelli, jak i izolacji Salmonelli.
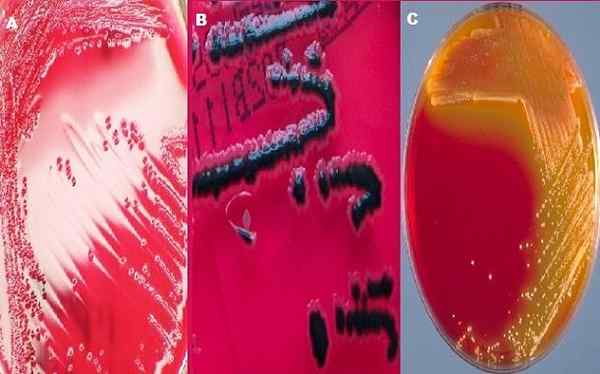
 Różnice w stosunku do kolonii Shigella, Salmonella i coli w agarach XLD. DO. Shigella SP, B. Salmonella SP, C. Coliforms. Źródła:. Przez: CDC/ Amanda Moore, MT; Dr Todd Parker; Audra Marsh, dzięki uprzejmości: Biblioteka obrazu zdrowia publicznego b. https: // prześlij.Wikimedia.org/wikipedia/commons/1/1f/salmonella_speciies_growing_on_xld_agar _-_ pokazanie_h2s_production _-_ detale.JPG c. Przez: CDC/DR. J. J. Rolnik, uprzejmość: Biblioteka obrazów zdrowia publicznego
Różnice w stosunku do kolonii Shigella, Salmonella i coli w agarach XLD. DO. Shigella SP, B. Salmonella SP, C. Coliforms. Źródła:. Przez: CDC/ Amanda Moore, MT; Dr Todd Parker; Audra Marsh, dzięki uprzejmości: Biblioteka obrazu zdrowia publicznego b. https: // prześlij.Wikimedia.org/wikipedia/commons/1/1f/salmonella_speciies_growing_on_xld_agar _-_ pokazanie_h2s_production _-_ detale.JPG c. Przez: CDC/DR. J. J. Rolnik, uprzejmość: Biblioteka obrazów zdrowia publicznego Agar XLD składa się z ekstraktu drożdżowego, sodu, ksylozy, lizyny, laktozy, sacharozy, tiosulfinianu sodu, cytrynianu żelazowego amonu, chlorku sodu, czerwonego fenolu i agaru i agaru. W większości laboratoriów bakteriologii Duo Agar XLD i SS Agar są używane do badania próbek kału w poszukiwaniu Shigella i Salmonella.
Inne laboratoria wolą połączenie Chromagar Salmonella i Agar XLD, a także inne dostępne opcje. Te duety można przygotować na podwójnych płytkach Petrie. Z jednej strony umieszczają agar XLD i po przeciwnej stronie drugie wybrane medium.
[TOC]
Podstawa
-Moc żywieniowa
Agar XLD ma ekstrakt drożdżowy, który służy jako źródło składników odżywczych do mikroorganizmów, które rozwijają się w tym agarie. Ponadto obecność węglowodanów (ksyloza, sacharoza i laktoza) zapewnia energię bakteriom, które mogą je fermentować.
-Średnia selektywność
Jako substancja hamująca przedstawia układ sodu; Zapobiega to wzrostowi bakterii dodatnich Grama, nadając średnio selektywny charakter.
-Moc różnicowa
Typowe kolonie Shigella
Jak już wspomniano, agar XLD zawiera ksylozę; Ten węglowodan jest fermentowany przez wszystkie bakterie, które rosną w tym pożywce, z wyjątkiem rodzaju shigella.
Może ci służyć: prawo Hardy-WeinbergJest to jedna z cech, które oferuje jego różnicowy charakter, ponieważ kolonie Shigelli rozróżnia resztę poprzez rozwijanie czerwonych kolonii, podczas gdy inne bakterie wytwarzają żółte kolonie.
Typowe kolonie Salmonella
Salmonella płciowa również feruje ksylozę, początkowo generując żółte kolonie. Jednak po wyczerpaniu węglowodanów ksylozy, atakuje lizynę za pomocą enzymu dekarboksylazy lizyny. Dekarboksylacja lizyny generuje alkalis, które sprawiają, że kolor kolonii i oryginalny czerwony do oryginalnego czerwonego.
To zachowanie jest wykonywane tylko przez Salmonellę, ponieważ coli, które dekarboxyle. Wynika to z faktu, że coli fermentują również laktozę i sacharozę; Dlatego produkcja kwasu jest bardzo wysoka, pozostawiając żółtą kolonię w tych bakteriach.
Należy zauważyć, że płeć Salmonella nie fermentuje sacharozy, ani laktozy.
H2S
Agar XLD pozwala również wykryć gatunki producentów Salmonelli H2S; Aby to zrobić, ma źródło siarczku reprezentowane przez tiosiulrafat sodu i deweloper reakcji, którym jest cytrynian żelazowy amon.
Ten ostatni reaguje z h2S (gaz bezbarwny) i tworzy widoczny czarny osad nierozpuszczalny siarczan żelaza. W tym sensie cechy kolonii Salmonelli będą czerwone z czarnym centrum.
Należy zauważyć, że dla reakcji h2S, potrzebne jest alkaliczne pH. Dlatego inne enterobakterie, które tworzą h2Nie mogą tego zrobić ani zrobić źle w tym środowisku, ponieważ wysoka kwasowość wytwarzają podczas fermentacji węglowodanów, które mają hamować lub utrudnia reakcję.
-Chlorek sodu, agar i fenol czerwony
Wreszcie, chlorek sodu utrzymuje równowagę osmotyczną; Agar jest środkiem zestalającym, a czerwona fenolu wykrywa zmiany pH, obracając kolor kolonii i medium.
Przygotowanie
Ważyć 55 graj XLD odwodnionych i rozpuszczanych w 1 litorze wody. Podgrzej i wstrząśnij mieszaniną, aż osiągnie temperaturę wrzenia. Nie przegrzewaj, ponieważ ciepło uszkadza medium i tworzy osad, który zmienia morfologię typowych kolonii.
Może ci służyć: proteoglikanyTego medium nie powinno być autoklawane. Podczas rozpuszczania się musisz przejść do łazienki od 50 ° C. Gdy chłodzenie powinno być podawane bezpośrednio na sterylnych płytach Petriego. Można je zaatakować w proste płyty lub podwójne płyty. Mogą się zestalić i przechowywać w lodówce do czasu użycia.
Temperament przed użyciem. Podobnie jak non -niesterylizowane medium, zaleca się przygotowanie go blisko daty użycia.
Ostateczne pH pożywki musi wynosić 7,4 ± 0,2. Kolor przygotowanych jest pomarańczowy czerwony, półprzezroczysty, bez osadu.
Jeśli można dodać agar ksylozy lizyny (XL), sód, tiosiarczan sodu i cytrynian żelaza amonic. W ten sposób uzyskuje się formułę agaru XLD.
Aplikacje
Agar XLD jest używany do odzyskiwania enteropathogenów, głównie z rodzaju Shigella, a druga płciowej salmonella. Przydaje się do oceny próbek stołka, wody i żywności.
Rodzaje próbek
Stołek
Próbki kału można zasiewać bezpośrednio w agarie XLD, co stanowi dobry rozkład materiału w celu uzyskania izolowanych kolonii.
Aby poprawić odzyskiwanie Salmonelli, XLD zgodził się ze środków wzbogacania Salmonella.
Żywność
W przypadku jedzenia buliony wzbogacające mogą być stosowane do Salmonella i Shigella. W przypadku Salmonella możesz użyć między innymi cystyny bulionu selenito, jasnozielonego bulionu tetrationat.
W przypadku Shigella można go wzbogacić z bulionem Shigella o 0,5 µ/ml novobiocina, inkubowanego w temperaturze 42 ° ± 1 ° C przez 16-20 godzin.
Woda
W analizie wody zalecane są między innymi technikę filtracji błony i zastosowanie agaru XLD.
Warunki wysiewu i identyfikacji
Podsiana pożywka inkubuje się w aerobiozie w 35 ° C przez 24 do 48 godzin.
Może ci służyć: flora i fauna IndiiTypowe kolonie każdego gatunku są obserwowane, podejrzane kolonie należy wykonać testy biochemiczne do identyfikacji.
QA
Aby ocenić średnią kontrolę jakości, można zastosować następujące szczepy bakteryjne: Salmonella Typhimurium ATCC 14028, Salmonella Enteritidis ATCC 13076, Salmonella Abony DSM 4224, Shigella Flexneri ATCC 12022, Shigella Sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Rodzaj Salmonelli charakteryzuje się prezentacją w tych średnich czerwonych koloniach z czarnymi ośrodkami lub całkowicie czarnymi koloniami. Podczas gdy w rodzajem Shigella kolonie muszą być czerwone, to znaczy kolor medium.
W przypadku Escherichia coli Oczekuje się, że będzie całkowicie lub częściowo zahamowany; Jeśli kolonie rosną, są żółte. Dla Proteus mirabilis Oczekuje się rzadkiego wzrostu z różowymi kolonami z czarnym ośrodkiem lub bez. Wreszcie rodzaj Klebsiella będzie rosła jako żółte kolonie.
Ostateczne rozważania
Agar XLD jest bardzo stosowany w laboratoriach bakteriologii ze względu na jego wysoką wydajność w celu odzyskania shigelli, a także ma dobre odzyskanie rodzaju Salmonella.
Rall i współpracownicy (2005) w swojej pracy zatytułowanej „Ocena trzech bulionów wzbogacających i pięciu solidnych mediów do wykrywania salmonelli w drobiu” pokazali, że z 3 klasycznych mediów (jasnozielony agar, SS Agar i Agar XLD), Agar XLD), Agar XLD uzyskał najlepszą wskaźnik odzysku.
Procent odzysku był następujący: 13.8% dla jasnozielonego agaru, 27.6% dla SS i 34.5% dla XLD. Przekroczył go tylko przez chromogeniczne Agar Agar Rambach z 48% odzyskiwaniem i chromagarem z 79.3%.
Bibliografia
- Choroby przenoszone przez żywność. Shigelloza. Dostępne na: Anmat.Gov.ar
- „Agar XLD." Wikipedia, bezpłatna encyklopedia. 9 lutego 2019, 11:46 UTC. 10 kwietnia 2019, 19:25 Wikipedia.org
- BBL Laboratories. Chromagar Salmonella / BD XLD Agar (Bipacca).2013 Dostępny na: BD.com
- Laboratorium. Neogen. XLD Agar. Dostępne na: Foodsafety.Neogen
- Laboratorium Francisco Soria Melguizo. XLD Agar. Dostępne na: http: // f-soria.To jest/informuje
- Rall L, Rall R, Aragon C, Silva M. Ocena trzech wzbogacania Bruths i pięciu mediów posiłkowych do wykrywania salmonelli w drobiu. Braz. J. Mikrobiol. 2005; 36 (2): 147-150. Dostępne od: Scielo.Br
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Pan -american Editorial S.DO. Argentyna.

